2021年6月7日,我院黄俊实验室和中科院生物物理所周政实验室合作在Molecular Cell杂志在线发表了题为“Structural insight into BRCA1-BARD1 complex recruitment to damaged chromatin”的研究论文,揭示了乳腺癌易感基因产物BRCA1-BARD1异源二聚体被招募到DNA双链断裂损伤(DNA double-strand breaks,DSBs)处的分子与结构基础。
基因组DNA每天都面临各种类型的损伤,DSBs是最为严重的损伤类型之一,单个裸露的DSB即可诱发细胞凋亡。DSB主要通过非同源末端连接(non-homologous end joining,NHEJ)和同源重组(homologous recombination,HR)两种方式来进行修复。同源重组修复发生在S和G2期,受损的DNA以姐妹染色单体上的同源序列为模板进行修复。因此,同源重组修复是十分精确的修复方式,一旦同源重组修复发生缺陷将导致基因组不稳定,引起包括肿瘤在内的多种疾病的发生。乳腺癌易感基因BRCA1编码的蛋白促进DSB修复选择精确的同源重组修复方式,对于维持基因组稳定性至关重要。携带BRCA1种系突变的个体一生累计乳腺癌发病风险高达80%,卵巢癌发病风险高达40%-60%。
BRCA1蛋白如何被招募到DNA损伤位点促进同源重组修复的机制还不明确。周政实验室和黄俊实验室合作通过结构生物学、生物化学和细胞生物学等手段阐明了BRCA1-BARD1异源二聚体通过BARD1结合核小体并识别组蛋白标记而被招募到DSB位点,进而促进同源重组修复(如图)。有意思的是,本研究发现BARD1通过识别泛素K63-E64位点,而非普遍存在的I44与I36位点与泛素结合,从而揭示了一种新的泛素识别模式。BARD1同时识别了核小体上DNA损伤诱导的H2AK15ub标记和新生核小体上未被甲基化修饰的H4K20me0标记。BARD1-泛素化核小体的结合是BRCA1-BARD1复合物在S/G2期被招募到DSB位点的基础。破坏BARD1-泛素化核小体的相互作用严重影响了BRCA1-BARD1复合物在DSB位点的招募,致使同源重组修复效率下降,从而导致细胞对同源重组修复缺陷的肿瘤靶向治疗药物-聚腺苷酸二磷酸核糖聚合酶抑制剂(PARPi)非常敏感。我们的进一步研究发现BARD1与泛素化核小体的结合界面上存在多个癌症相关的突变,提示相关的BARD1突变破坏其识别泛素化核小体的能力,导致同源重组修复缺陷,从而导致癌症的发生。
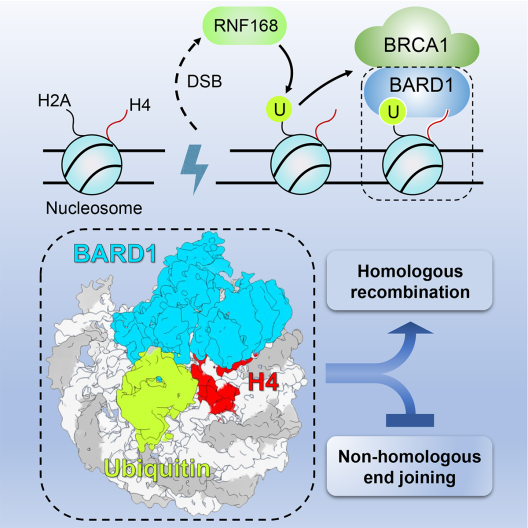
图:BRCA1-BARD1复合物识别泛素化的核小体,促进同源重组修复
本研究解析了BRCA1-BARD1复合物被招募到DNA损伤位点的分子和结构基础,诠释了相关BARD1突变的致病机理,同时为相应的癌症治疗提供了新的思路。
黄俊实验室博士后韩金花是本文的共同第一作者,黄俊教授和生物物理所周政研究员是该论文的共同通讯作者。该研究受到国家科技部重点研发计划、国家自然科学基金、霍英东青年教师基金等项目的资助。
原文链接:https://doi.org/10.1016/j.molcel.2021.05.010

