2013年7月26日,浙江大学生命科学研究院叶升实验室在Science杂志上发表题为“FtsZ protofilaments use a hinge-opening mechanism for constrictive force generation”的文章。
细胞骨架蛋白FtsZ(细胞分裂温度敏感突变体Z)能够自组装成为细菌细胞分裂过程中的一个关键细胞器�Z环。在细胞分裂过程中,Z环定位在细胞中部�未来细胞分裂位点,随着分裂隔膜形成,Z环通过水解GTP,将化学能转化成为向内拉伸的机械力,缩小自身直径,拉动隔膜内陷,直至最终收缩分裂细胞。
本项研究的目的是回答细菌细胞骨架蛋白FtsZ研究领域中的一个关键问题:Z环是怎样将GTP水解的化学能转换为向内收缩的张力?围绕这个问题,本文以所得到的FtsZ原丝纤维的晶体结构为基础,设计一系列的FtsZ突变体,结合体内互补实验、GTPase酶活测定、体外聚合后电子显微镜负染观测,同时辅以分子动力学模拟,提出并验证了一个Z环是怎样将GTP水解的化学能转换为向内收缩的张力的分子机制。
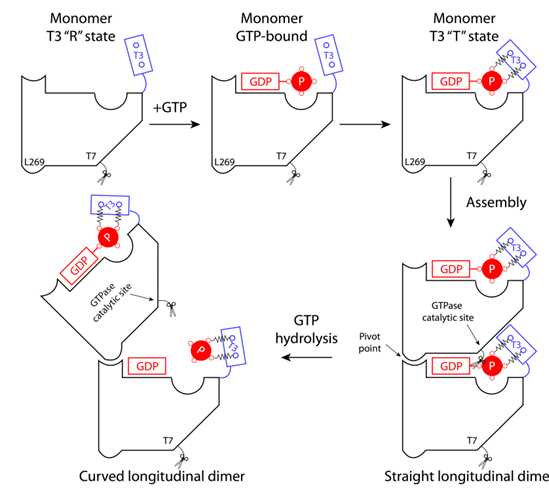 |
| 图1: GTP水解导致的FtsZ原丝纤维从垂直到弯曲的构象变化模型。 |
如图1所示,我们发现FtsZ单体在结合GTP和结合GDP时的主要构象变化发生在T3环状结构区(T3 loop),GTP的g-磷酸基团能够和T3环的主链胺基形成两个强氢键相互作用,从而锁定T3环处于一种紧密结合构象(T 构象)。当FtsZ结合GDP,失去了这两个强氢键相互作用后,T3环除了可以处于紧密结合构象之外,还可以处于一种松弛构象(R 构象)。此外,在FtsZ原丝纤维的垂直构象中有两个非常关键的结构特征,首先,T3环处于紧密结合构象并和上面亚基的T7环相互作用,使得T7环上两个保守的天冬氨酸靠近GTP g-磷酸基团附近的一个水分子,在催化GTP水解的反应中,这两个天冬氨酸的酸性残基极化这个水分子,使其能够进攻GTP的 g-磷酸基团。其次,在FtsZ原丝纤维的垂直构象中,相邻两个FtsZ亚基紧密结合,严丝合缝,夹在两亚基之间的GDP是处于一种封闭状态,除非两个亚基打开,是无法自由出来。因此我们推测,当GTP发生水解,GTP g-磷酸基团和b-磷酸基团之间的共价键断裂,由于二者都携带负电荷,它们之间会产生一个巨大的排斥力,当二者被封闭在两个FtsZ亚基之间时,就会如图所示,这个巨大的排斥力驱使GTP g-磷酸基团推动T3环发生一个从紧密结合构象到松弛构象的构象变化,从而使两个FtsZ亚基之间的结合从T3环和T7环接触处打开,相邻亚基围绕支点发生折叠。GTP水解的化学能就这样转变成为相邻FtsZ亚基之间的构象变化。
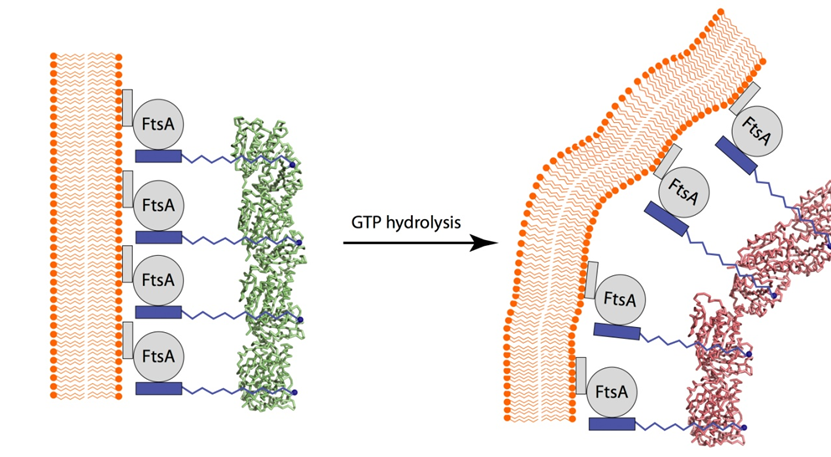 |
| 图2:GTP水解导致的FtsZ原丝纤维从垂直到弯曲的构象变化从而导致细胞膜弯曲模型。 |
上述GTP水解而导致的FtsZ原丝纤维构象变化如何转化为细菌细胞分裂向内收缩的张力呢?FtsZ的C端肽链没有一个稳定的构象,这段肽段会和FtsA相结合,而FtsA通过它的C端一个疏水的a-螺旋嵌在细胞膜上,Z环就是这样被固定在细胞膜上位于隔膜最内端(图2)。上述GTP水解而导致FtsZ原丝纤维的构象变化则通过FtsA施加一个改变细胞膜曲度的一个向内收缩的张力(图2)。
肺结核病是由结核分枝杆菌感染肺部引起的严重危害人类健康的一种慢性传染病。由于细菌耐药性问题日益严重,越来越多的致病菌对现有抗生素产生了耐药性,开发新靶点的药物迫在眉睫。在这其中,细菌细胞的分裂蛋白FtsZ是最有希望作为新广谱抗菌药物的靶标。本项研究不仅将帮助我们从结构生物学角度更好地理解细胞骨架自组装与调控机制,为进一步研究定位在Z环上的其他细胞分裂事件打下良好基础,还能为以Z环为靶向系统的药物设计提供直接的结构信息,从而使以分子结构为基础的药物设计成为可能。
叶升实验室博士研究生李颖为本文第一作者,叶升博士为该文章通讯作者,论文的其他作者有本院程译文,尚卫娜,清华大学的赵玲云和王宏伟博士,美国斯坦福大学的Kerwyn Casey Huang博士和Jen Hsin博士。该研究受到科技部蛋白质重大专项、国家自然科学基金、浙江省杰出青年基金、教育部博导基金、985高校重点建设专项资金、浙江大学基本科研业务费专项基金和中央高校基本科研业务费专项资金资助。
生命科学研究院
2013年7月26日




