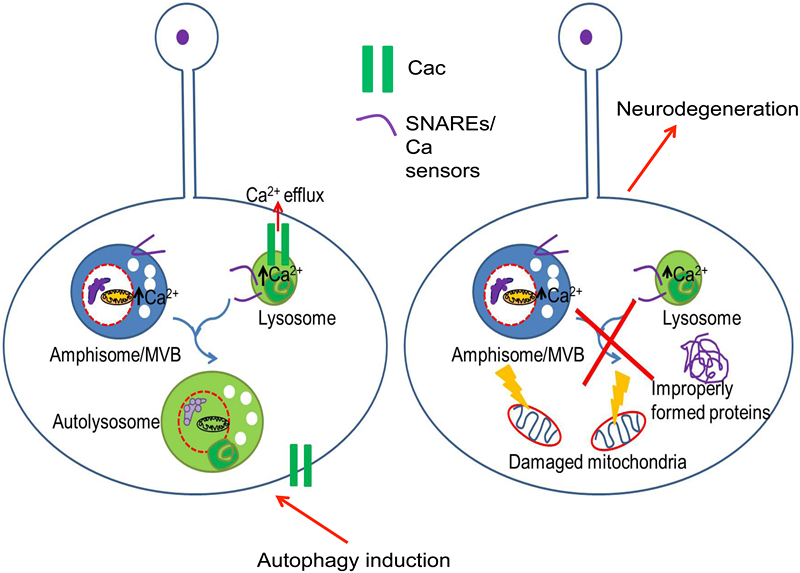
2015年3月26日,浙江大学生命科学研究院佟超课题组在Plos Biology上发表研究论文,揭示一个电压门控钙离子通道(Voltage gated calcium channel, VGCC)在溶酶体融合和细胞自噬过程中发挥关键作用从而维持神经系统的稳态。
VGCC在神经递质释放过程中调控神经递质小泡与突触前膜融合。VGCCs的遗传突变会导致许多神经系统疾病,如发作性共济失调,失神癫痫和偏头痛等,危害人类健康。这些疾病又往往和神经退行性改变相联系,但是其中的致病机理尚不清楚。
在一个旨在获得能导致神经系统功能异常突变的大规模遗传筛选中,作者发现编码VGCC亚基的cacophony基因的突变果蝇感光神经元终端逐渐积累了大量自噬泡,并且最终导致了神经元终端和周围神经胶质细胞的退行性变化。实验结果提示自噬泡与溶酶体之间的融合过程存在障碍。为了检测VGCC是否在哺乳动物中发挥相似的功能,作者又对编码VGCC不同亚基的基因Cacna1a和Cacna2d2的突变小鼠进行了研究,发现这些突变都会导致小鼠小脑出现自噬障碍,与细胞自噬相关基因神经特异性敲除小鼠的表型非常类似。他们还进一步发现VGCC的亚基CACNA1A定位于溶酶体上,其钙离子通道活性是溶酶体膜融合过程所必需的。
该项研究揭示了VGCC在神经系统中调节溶酶体与自噬泡等细胞器融合的新功能。提示神经细胞可能利用与神经递质释放极为相似的分子机制调控溶酶体与其他细胞器的膜融合过程。这一机制的发现为更好地理解VGCC相关疾病的发病机制与发生发展过程提供了一个全新的视角。
该研究受到国家自然科学基金面上项目、科技部973项目、教育部博导基金资助,为佟超实验组与美国贝勒医学院Hugo Bellen 实验室合作完成,2011级博士生田雪君为第一作者。