2017年11月14日,汪方炜实验室在国际著名学术杂志EMBO Reports在线发表题为“A kinase-dependent role for Haspin in antagonizing Wapl and protecting mitotic centromere cohesion”研究论文,阐述姐妹染色体粘连调控和染色体稳定性保护的新机制。
正常人体细胞含有的46条染色体经过DNA复制变成46对姐妹染色单体,并在随后的有丝分裂期被均等地分配至两个子细胞,从而实现亲代与子代之间遗传物质的稳定传递。此过程受到细胞的严密调控,极细微的错误也可能导致子细胞染色体数目的异常,以及染色体的不稳定性和细胞的癌变。
姐妹染色单体配对的建立和维系依赖于黏连蛋白复合体(cohesin)形成的环状结构。在细胞进入有丝分裂的早期,染色体臂上的cohesin在其调节亚基Wapl的作用下被大量去除,而着丝粒部位的cohesin必须予以保留,以确保所有的染色体均能与纺锤体正确连接并整齐地排列在中期赤道板上。在前期的研究中(Zhou L and Liang C et al., Current Biology, 2017),汪方炜实验室的博士生周琳莉和梁材等发现,cohesin的调节亚基Pds5B通过结合蛋白激酶Haspin氨基端的保守基序PIM(Pds5-interacting motif)将Haspin招募至染色体的着丝粒区;通过实验手段破坏Pds5B与Haspin的结合,则会导致姐妹染色体粘连缺陷和染色体不稳定性的发生。
在随后的研究中,汪方炜实验室的博士生梁材和陈亲富等发现,Haspin的激酶域对于姐妹染色体粘连具有重要保护作用。进一步的机理研究显示,一方面,Haspin的激酶域以较强的亲和力结合Wapl的重要基序PIM,从而竞争性地阻碍Pds5B结合Wapl的PIM;另一方面,Haspin磷酸化Wapl的PIM并直接削弱Wapl结合Pds5B的能力。通过这一双重机制,Haspin活性激酶域有效地抑制了Wapl与Pds5B的结合,拮抗了Wapl对着丝粒区cohesin的去除作用,确保了姐妹染色体的正常粘连和分离,从而实现对染色体稳定性的保护。
这些研究结果鉴定了Haspin的新底物Wapl,以及Wapl磷酸化修饰调控黏连蛋白复合体环状结构的新通路,阐明了Haspin如何“以少胜多”有效抑制着丝粒区Wapl活性进而保护姐妹染色体粘连的分子机制。此项研究成果有助于深入理解癌细胞染色体不稳定性的发生原因,并启发基于肿瘤细胞染色体粘连缺陷的抗癌研究。
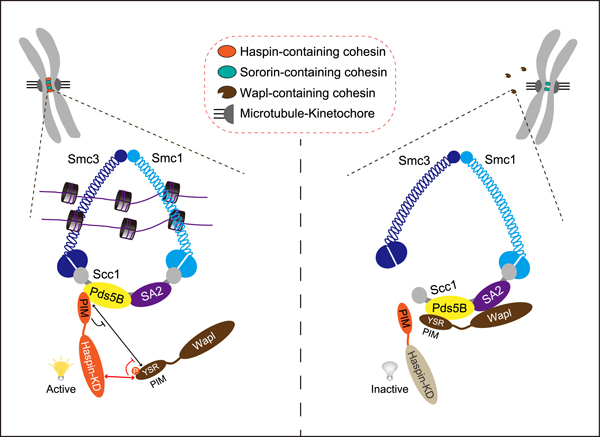
插图注释:(左)在正常情况下,Haspin的PIM结合Pds5B并被招募至着丝粒区,Haspin的激酶域结合并磷酸化Wapl的PIM,从而抑制Wapl与Pds5B的结合;(右)失去激酶活性的Haspin不能磷酸化Wapl,Wapl得以结合Pds5B并破坏cohesin的环状结构,使得着姐妹染色体粘连变弱,并导致染色体的不稳定性。
2015级研究生梁材和陈亲富为本文的第一作者,汪方炜教授是通讯作者。此项研究由国家重点研发计划、国家自然科学基金(优青和面上)、和英国皇家学会牛顿高级学者基金资助。
原文链接:http://embor.embopress.org/content/early/2017/11/14/embr.201744737




