2017年12月13日,张龙课题组在Nature Communications杂志上在线发表题为“Breast cancer metastasis suppressor OTUD1 deubiquitinates SMAD7”的研究论文。该文章发现了新的肿瘤转移抑制因子OTUD1(OTU domain-containing protein 1),并阐明其抑制肿瘤转移的分子机制,证实该因子抑制功能的丢失将会促进肿瘤的恶化。
肿瘤转移是导致癌症病人死亡的一个非常重要的原因,多达90%的实体瘤患者死于肿瘤转移。为探究新的转移关键因子,研究者建立了小鼠体内肿瘤转移的筛选模型,通过体内筛选去泛素化酶shRNA文库,发现了一个新的肿瘤转移抑制因子去泛素化酶OTUD1。
通过功能实验,研究者发现OTUD1是通过抑制肿瘤干性来拮抗肿瘤转移的,并且其功能依赖于去泛素化酶活性。进一步研究发现,OTUD1靶向转移生长因子β (TGF-β)信号通路,通过分子机制的探究,发现OTUD1去泛素化TGF-β信号通路的主要抑制蛋白SMDA7,一方面OTUD1去泛素SMAD7的K48泛素化链从而稳定SMAD7的蛋白水平,另一方面特异性的切除SMAD7上的K33泛素化链,稳定SMAD7-SMURF2复合物的形成从而促进TβRI降解。OTUD1抑癌功能的丧失与病人的不良预后呈正相关。
此项研究不仅发现了调控肿瘤转移新的抑制因子OTUD1,而且揭示了OTUD1如何通过去泛素化SMAD7抑制TGF-β信号的分子机制,解释了在晚期肿瘤中OTUD1抑制功能的丢失促进了TGF-β向促癌功能的转变,对临床预防肿瘤恶化和抗癌药物的研究提供了重要的理论支持。
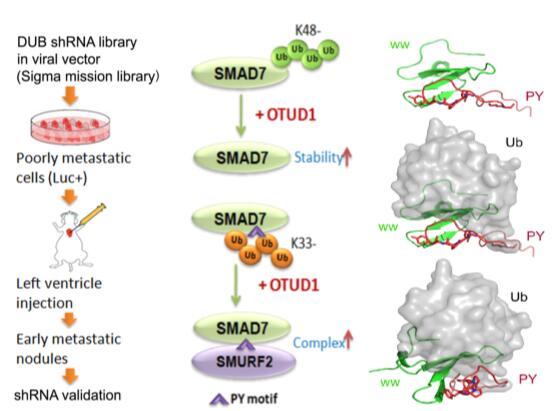
体内基因筛选将OTUD1鉴定为乳腺癌转移的抑制因子(Left panel) 。OTUD1去泛素化SMAD7的K48泛素化链稳定SMAD7;去泛素SMAD7的K33泛素化链,稳定SMAD7-SMURF2复合物促进TβRI降解抑制TGF-β信号通路(middle&Right panels)
张龙实验室博士生张正奎,硕士生范瑶和已毕业博士生谢枫是该文的共同第一作者,张龙教授是本文的通讯作者。该研究受到科技部"蛋白质机器与生命过程调控"重点专项、国家自然科学基金、浙江省重点研究发展项目、浙江省杰出青年基金等项目资助。
文章链接:https://www.nature.com/articles/s41467-017-02029-7




