2018年9月21日,靳津实验室在Journal of Autoimmunity发表题为"CRL4DCAF2 is required for mature T-cell expansion via Aurora B-regulated proteasome activity"的研究论文,揭示了CRL4泛素连接酶的一个底物识别蛋白DCAF2(也叫CDT2或DTL)作为细胞周期调节关键蛋白在有丝分裂过程中起到重要作用。
抗原特异性T细胞的克隆扩增对于诱导有效的适应性免疫应答是必需的。T细胞的增殖循环受到Cyclin/CDK复合物的有序表达的严格控制,这些激酶经过定期的蛋白质分解以维持T细胞的完整性。最近,一种新型的E3泛素连接酶CRL4DCAF2被鉴定为在S期中阻止DNA再复制的主调控因子。CRL4DCAF2促进各种底物如CDT1、P21和SET8的泛素依赖性蛋白水解。然而,由于DCAF2缺陷小鼠的胚胎致死性,CRL4DCAF2是否或如何调节T细胞维持,其基础机制仍知之甚少。我们繁殖得到在T细胞中条件性敲除DCAF2的小鼠,研究发现DCAF2的表达与T细胞活化密切相关。
IL-2长期以来被公认为是一种主要的T细胞生长因子,也是G1/S期进展的调节因子。RNA SEQ分析表明,在DCAF2缺乏的T细胞中IL-2的诱导被消除,但外源性IL-2不能恢复DCAF2缺失的naïve T细胞的存活能力。在DCAF2缺乏的T细胞中,细胞周期抑制子p21诱导因子p53的缺失不能减轻M期阻滞和增殖缺陷。c-myc也不参与CRL4DCAF2介导的T细胞扩增和细胞周期的变化。
在这项研究中,极光B-磷酸化26S蛋白酶体被证明在细胞周期调控中起着重要的作用。26S蛋白酶体含有超过300个在细胞周期中动态调节的磷酸化位点,已被证明在多种水平调节不同细胞周期阶段的转录和翻译后修饰。DCAF2在M期时限制活化T细胞AurkB启动子位点的H4K20me1修饰。Aurora B已被鉴定为增强26S蛋白酶体活性的关键激酶,对于CRL4DCAF2依赖的T细胞增殖是必不可少的。26S蛋白酶体在细胞周期调控过程中被Aurora B动态磷酸化,Aurora B在T细胞中的沉默严重损害26S蛋白酶体活性,导致细胞周期蛋白依赖性激酶CDK1过度累积,细胞阻滞于M期。我们的研究显示了一个新的调节原发性T细胞增殖的信号网络,对T细胞介导的自身免疫性疾病具有深刻的治疗意义,AuroraB磷酸化的特异位点及其在蛋白酶体活性中的潜在功能有待进一步研究。
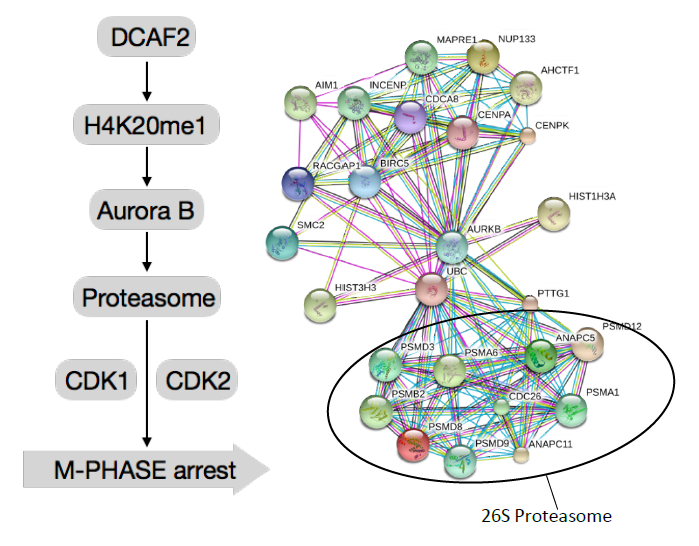
Figure1,DCAF2的敲除限制活化T细胞AurkB启动子位点的H4K20me1修饰。研究发现Aurora-B激酶与蛋白酶体之间存在相互作用,AurkB激酶减少导致蛋白酶体活性降低。细胞周期蛋白依赖性激酶CDK1过度累积,CDK2减少,细胞可以启动但是不能完成细胞周期,最终阻滞于M期。
靳津课题组博士研究生范柯琪和王斐为共同一作,靳津教授和郭行教授为本文的通讯作者。本研究得到国家重点研究开发计划(2018YFD0500)、国家自然科学基金(81572651/81771675)、中央大学基础研究经费(2016QN81013)、浙江大学基础研究专项基金的资助。
原文链接:https://www.sciencedirect.com/science/article/pii/S0896841118303676




