2018年11月21日,我院张龙实验室在Molecular Cell发表题为“OTUB2 promotes cancer metastasis via Hippo-independent activation of YAP and TAZ”的研究论文,揭示了去泛素化酶OTUB2不依赖于Hippo信号直接激活YAP/TAZ的分子机制,解释了恶性肿瘤中YAP/TAZ蛋白高度积累的原因。
转录调节因子 YAP/TAZ在肿瘤的转移和恶化中有着重要的作用。在恶性肿瘤中YAP/TAZ显示出很强的激活,YAP/TAZ的激活可以诱导肿瘤干细胞特性的产生,促进肿瘤的生存和转移,增强耐药性(Cordenonsi et al., 2011; Zanconato and Piccolo, 2016),但在乳腺癌的临床病人样本中,并没有发现类似肝癌和髓母细胞瘤中YAP基因的扩增,TAZ基因的扩增也相对很少(Overholtzer, M. et al., 2006; Fernandez, L. A. et al., 2009)。相反,Hippo-信号的组分在上述肿瘤中很少发生突变,那么是什么原因导致恶性肿瘤YAP/TAZ的高表达和激活呢?
该项研究中,张龙研究团队在乳腺癌转移过程中发现OTUB2是一个潜在的促进乳腺癌转移的因素。实验证明OTUB2主要通过促进乳腺癌干细胞的产生来增强肿瘤的转移。OTUB2高表达的乳腺癌病人倾向于较差的生存预期;基因富集分析发现,OTUB2与抑癌基因p53/PTEN/BRCA等失活和原癌基因KRAS的激活等特征相关。为了探究OTUB2促进癌症转移的分子机制,研究人员综合利用RNA-seq转录组和串联质谱蛋白组等方法证实OTUB2激活YAP/TAZ信号通路;OTUB2可以去除YAP/TAZ的多聚泛素化链从而稳定YAP/TAZ且OTUB2对YAP/TAZ的稳定作用不依赖于上游Hippo的失活。非常有意思的是,从原核细胞中纯化的OTUB2并不能在体外直接去除OTUB2的泛素化;免疫共沉淀与YAP/TAZ相互作用的去泛素化酶时也并未发现很强的结合蛋白;这这些结果提示OTUB2对YAP/TAZ的调控活性可能受到其本身蛋白翻译后修饰的调控或触发。
进一步研究发现,OTUB2的赖氨酸233位会被多聚SUMO化修饰且SUMO化修饰对于OTUB2调控 YAP/TAZ是必需的。当SUMO化位点发生失活性突变后,OTUB2既不能与YAP/TAZ发生相互作用,也不能去除YAP /TAZ的泛素化。相反,模拟SUMO化修饰的OTUB2则显示出更强的针对YAP/TAZ的去泛素化能力。SUMO化修饰经常通过 SUMO:SIM(SUMO-interacting motif)相互作用进一步调控底物蛋白的功能。该研究发现,YAP和TAZ上都存在进化上(从果蝇到人)高度保守的SIM基序,介导了YAP/TAZ与多聚SUMO化的OTUB2相互结合。在一系列促肿瘤转移的因子中,研究人员发现EGF会增强OTUB2的SUMO化并进一步发现其其下游KRAS的激活可以强烈地促进OTUB2的SUMO化从而稳定YAP/TAZ的蛋白水平。尽管KRAS、HRAS和N-RAS的突变在乳腺癌中相对罕见,但RAS信号通路的在50%的乳腺癌中高度活化,被认为是肿瘤复发的主要原因(Sivaraman et al.,1997; von Lintig et al., 2000)。因此,该研究不仅揭示了去泛素化酶 OTUB2激活YAP/TAZ、逃脱Hippo控制并促进癌症转移的分子机制,也首次将YAP/TAZ激活的信号网络纳入为EGF/RAS的下游。EGF受体信号传导中的激活突变经常在人类癌症中发现,突变体EGFR作为癌症治疗的有效靶标。基于该项研究,RAS或EGFR产生的致癌信号可能部分经由YAP / TAZ活化介导。此外,靶向YAP / TAZ可能是RAS突变或RAS激活的肿瘤的潜在治疗策略。
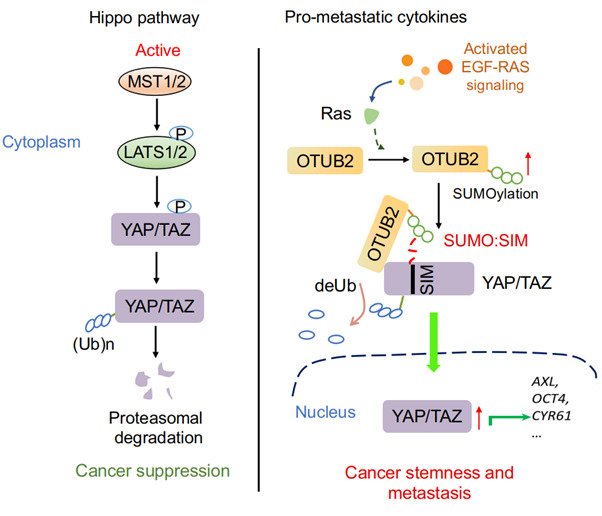
图注:OTUB2调控YAP/TAZ活性促进肿瘤恶化和转移的工作示意图
张龙实验室14级博士研究生张正奎为本文的第一作者,张龙教授为本文的通讯作者。该项研究得到中国科技部重点研发计划(2016YFA0502500 to L.Z.)、国家自然科学基金(31471315, 31671457, 31741086 and 91753139 to L.Z.)、浙江省杰出青年基金(LR14C070001 to L.Z.)、浙江省科技重大项目(No. 2015C03045 to M.Z.)等基金的支持。
原文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(18)30890-6




