有丝分裂期染色体的正确分离是亲代与子代细胞间遗传物质稳定传递的基础。作为有丝分裂最重要的调节者(此处可以省略“之一”),染色体乘客复合体(chromosomal passenger complex,简称CPC)被著名细胞生物学家、英国爱丁堡大学的William Earnshaw教授称为“有丝分裂教父” [The chromosomal passenger complex (CPC): from easy rider to the godfather of mitosis. Carmena M et al., Nat Rev Mol Cell Biol, 2012]。染色体乘客复合体的核心组分包括INCENP、Survivin、Borealin和Aurora B四个蛋白,其中最大的骨架亚基INCENP的氨基端CEN-BOX结合Survivin和Borealin构成CEN功能模块(CEN module),负责介导CPC在着丝粒(centromere)的定位,INCENP羧基端的IN-BOX则结合蛋白激酶Aurora B组成IN/AURKB功能模块(IN/AURKB module),负责激发并维持最大化的Aurora B激酶活性(图一)。这两个功能模块间存在间接的交互对话:CEN模块通过介导CPC在着丝粒区的富集促进Aurora B的激酶活性,而IN/AURKB模块则可以通过调节相关蛋白激酶对组蛋白的磷酸化影响CEN模块在着丝粒的定位。此外,INCENP还与异染色质蛋白HP1直接结合,但其功能不明。
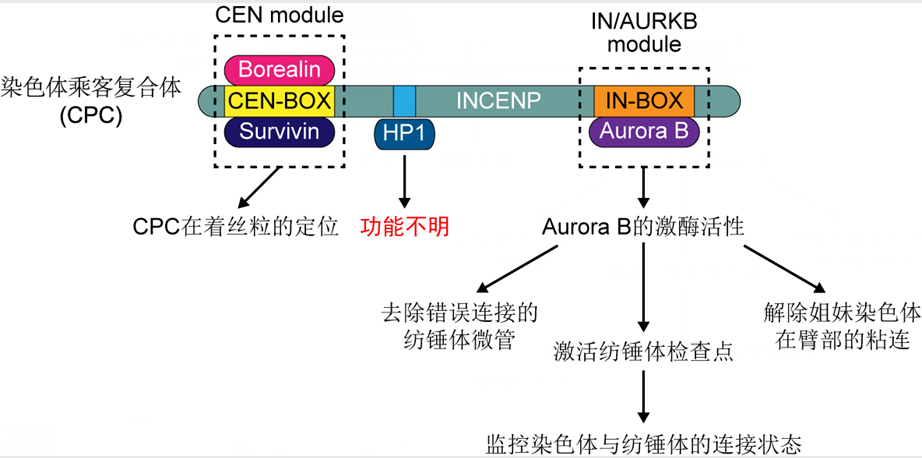
图一:CPC的组分蛋白、功能模块及其在调控有丝分裂期染色体分离中的作用。
染色体乘客复合体的重要功能及其复杂而精细的调节机制是有丝分裂研究领域的重要课题,同行竞争异常激烈。目前已知,CPC的激酶活性对于有丝分裂期染色体的正确分离极其重要。一方面,Aurora B通过磷酸化动粒(kinetochore)区的相关蛋白(如Hec1)去除错误连接的纺锤体微管(spindle microtubule);另一方面,Aurora B激酶活性促进纺锤体组装检查点(spindle assembly checkpoint,简称SAC)相关效应蛋白在动粒区的定位,从而激活SAC并监控染色体与纺锤体的连接状态;此外,Aurora B还能通过磷酸化Sororin参与解除姐妹染色体在臂部的粘连。用RNA干扰技术敲减四个核心组分中的任何一个蛋白,都会导致CPC整体蛋白稳定性和Aurora B激酶活性的大幅下降,严重影响有丝分裂进程。若用小分子化合物“简单粗暴”地抑制Aurora B的激酶活性,则会破坏动粒和着丝粒的结构,并改变CPC在染色体上的定位。因为这些固有问题的存在,一直不清楚CPC是否有不依赖于Aurora B激酶活性的功能。
为了解答这一科学问题,浙江大学生命科学研究院汪方炜实验室的博士生易琦在做本科毕业设计实验时就着手尝试将外源INCENP基因导入不同类型的细胞中,并成功地在人宫颈癌来源的HeLa细胞中获得稳定表达外源INCENP(野生型或多种突变体)的若干细胞系,随后利用CRISPR-Cas9基因编辑技术或RNA干扰技术实现了内源INCENP的稳定敲除或瞬时敲减。以此为基础,易琦和陈亲富两位博士生合作开展了后续一系列功能和机理探究实验。Aurora B底物蛋白磷酸化的免疫荧光染色实验显示,当细胞表达不能结合HP1的INCENP突变体时,Aurora B的激酶活性和CPC在有丝分裂期染色体上的定位基本正常,而HP1则不能富集于着丝粒区,说明在有丝分裂期CPC作用于HP1的上游并将后者招募至着丝粒区。包括活细胞实时显微成像在内的进一步功能分析实验发现,破坏INCENP与HP1的结合导致姐妹着丝粒粘连强度显著下降,染色体错误分离的发生率也明显上升。通过表达与着丝粒结构蛋白CENP-B的融合蛋白,将HP1及其下游蛋白Haspin强行招募至着丝粒区,则可以修复这些缺陷。用RNA干扰技术敲减黏连蛋白复合体(cohesin)的破坏者Wapl也得到了类似的修复效果。这些结果说明INCENP通过结合HP1以不依赖于Aurora B激酶活性的方式拮抗Wapl并保护着丝粒区的cohesin。
此外,陈亲富等还发现,在稳定表达HP1与CENP-B融合蛋白的细胞系中施加Aurora B激酶活性的小分子化合物抑制剂,仍会进一步减弱着丝粒的粘连强度,并显著降低Wapl的另一个拮抗蛋白Sgo1在着丝粒区的定位。通过将介导组蛋白H2A第120位苏氨酸磷酸化(H2A-pT120)的蛋白激酶Bub1强行招募至着丝粒区,则可以在一定程度上修复这些缺陷。这些结果说明CPC也可以通过Aurora B激酶活性保护着丝粒粘连,而且此通路依赖于Bub1在动粒区的定位。
基于这一系列实验结果,并结合汪方炜实验室近期发表的相关论文(Zhou L et al., Current Biology 2017; Liang C et al., EMBO Reports 2018;Yi Q et al., EMBO Reports 2018; Qi F et al., Cell Reports 2018; Liang C et al., The Journal of Biological Chemistry 2018),论文提出了染色体乘客复合体保护着丝粒区姐妹染色体粘连的工作模型(图二):一方面,通过不依赖于Aurora B激酶活性的方式,INCENP结合并招募HP1至着丝粒,促进Haspin在着丝粒区的富集并拮抗Wapl对cohesin的破坏作用;另一方面,Aurora B以目前尚未完全明确的机制促进SAC激酶Mps1在动粒区的定位,从而使得Sgo1经由pKNL1-Bub1-H2A-pT120信号轴(p代表磷酸化)富集于着丝粒区并拮抗Wapl。
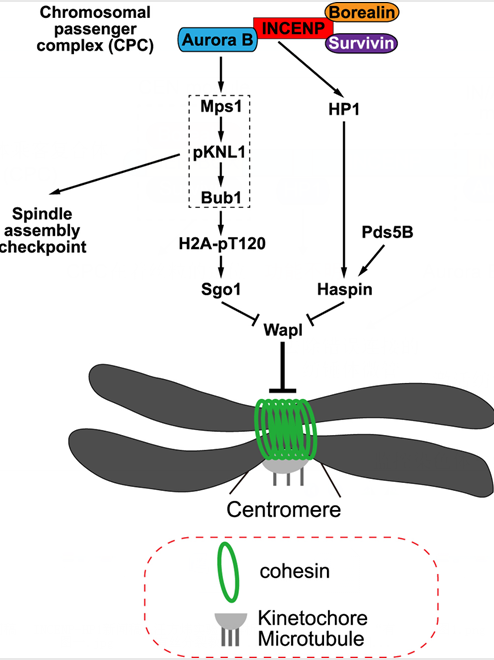
图二:CPC以Aurora B激酶活性依赖或非依赖的方式保护着丝粒区姐妹染色体粘连的分子模型。
这篇题为“Aurora B kinase activity-dependent and -independent functions of the chromosomal passenger complex in regulating sister chromatid cohesion”研究论文于2018年12月6日在线发表于The Journal of Biological Chemistry杂志。汪方炜教授是通讯作者,易琦和陈亲富为共同第一作者,张妙和梁材等同学也有贡献。汪方炜实验室的研究由国家重点研发计划(2017YFA0503600)、国家优秀青年基金(31322032)及国家基金面上项目(31771499、31571393、31371359)、NSFC-RS中英人才基金(31561130155)、英国皇家学会牛顿高级学者基金(NA140075)、浙江省自然科学基金杰出青年项目和重点项目(LR13C070001、LZ19C070001)、中央高校基本科研业务费专项资金以及浙江大学自主科研计划校长专项等资助。
原文链接:http://www.jbc.org/content/early/2018/12/06/jbc.RA118.005978.abstract




