2019年12月23日,我院汪方炜实验室在国际著名学术期刊Journal of Cell Biology在线发表了题为“Centromere-localized Aurora B kinase is required for the fidelity of chromosome segregation”的研究论文,解析了有丝分裂期染色体分离的重要调控机制。
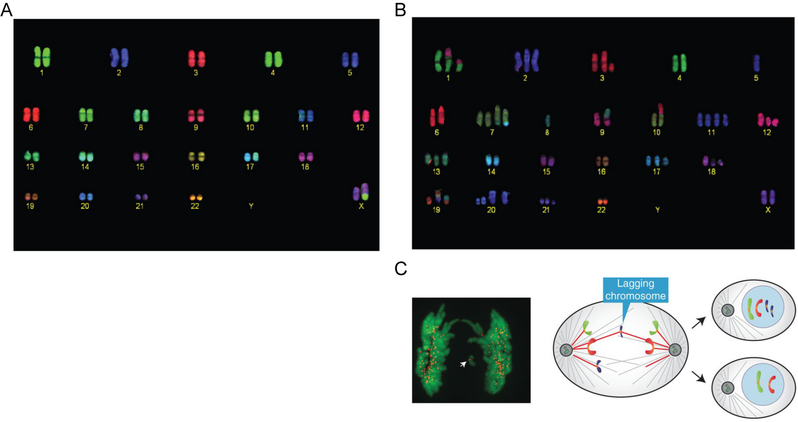
图1:(A和B)正常人体细胞中的46条染色体和人结肠癌细胞中的59条染色体(Janssen A et al., Science, 2011);(C)有丝分裂期染色体错误分离产生非整倍体细胞的示意图(Varetti G et al., Cold Spring Harb Perspect Biol, 2014)。
癌细胞的重要特征是染色体数目的异常,即非整倍体。科学家们在约90%的实体瘤细胞和70%的血癌细胞中都发现了染色体数目异常的现象(Beroukhim R et al., Nature, 2010)。如图1所示,一个正常的人体细胞含有46条染色体(图1A),而另一个结肠癌细胞则含有59条染色体(图1B)。产生非整倍体细胞的根本原因是有丝分裂期染色体的错误分离(图1C),而染色体精确分离的前提是其动粒与纺锤体微管的正确连接。在有丝分裂的早期,随着核膜的崩解,动粒与微管之间会以随机的方式发生多种形式的连接,但正确的连接方式只有一种,即每条姐妹染色单体上的动粒分别与来自纺锤体一极的微管相连(图2)。在姐妹染色单体分离前,动粒与微管之间的各种错误连接必须得以纠正,否则会导致染色体的错误分离,进而产生非整倍体细胞并危害健康。在由数十万亿个细胞构成的成人体内,每时每刻会有上百万个细胞在进行着有丝分裂,那么,如此众多的细胞如何保证在每一次有丝分裂时纺锤体与染色体正确连接,从而将遗传物质均等地分配至两个子细胞?
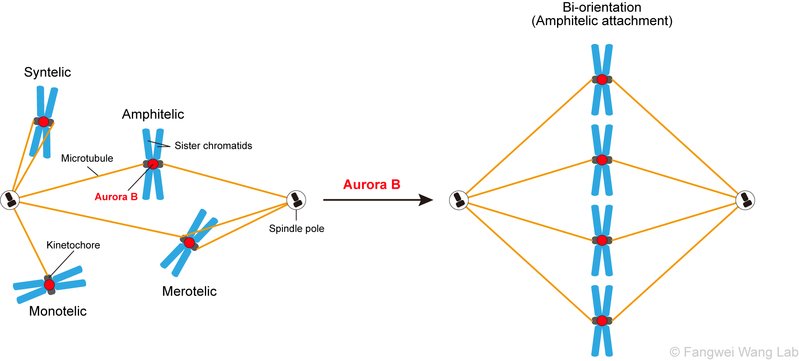
图2:蛋白激酶Aurora B在纠正动粒与微管的错误连接中发挥重要作用。
目前已知,染色体乘客复合体(Chromosomal Passenger Complex,简称CPC)的激酶亚基Aurora B在纠正动粒与微管错误连接的过程中发挥关键作用。在染色体分离前,依赖于组蛋白H3第3位苏氨酸的磷酸化(H3pT3)和H2A第120位苏氨酸的磷酸化(H2ApT120),Aurora B高度富集于内层着丝粒区(Kelly A et al., Wang F et al., Yamagishi Y et al., Science, 2010)。目前,有三种假设模型被用来解释H3pT3和H2ApT120如何使Aurora B定位至着丝粒区:一种模型认为(图3A),H3pT3和H2ApT120在着丝粒区分布的交叉区域招募了CPC(Carmena M et al., Nat Rev Mol Cell Biol, 2012),另外两种模型认为(图3B和C),CPC通过其Survivin和Borealin亚基分别直接或间接地结合位于同一核小体或相邻核小体上的H3pT3和H2ApT120(Vader G and Lens S, Current Biology, 2010; Trivedi P and Stukenberg PT, Trends Biochem Sci, 2015)。这些假设模型要么分子机制不明,要么实验证据不全。此外,Aurora B在着丝粒区的定位对于染色体正确分离的重要性尚不清楚(Tanaka T et al., Cell, 2002; Liu D et al, Science, 2009; Campbell C and Desai A, Nature, 2013)。

图3:H3pT3和H2ApT120招募Aurora B至着丝粒区的三种假设模型。
汪方炜实验室研究发现,在表达不能结合H3pT3的Survivin突变体的细胞中,染色体分离并没有出现明显的问题。当用荧光显微镜实时追踪活细胞的有丝分裂进程时,张振蕾同学发现染色体在中期赤道板上的整列并无显著异常,但姐妹染色单体分离的时间被明显延迟,暗示纺锤体检查点的沉默受到抑制。梁材同学在免疫荧光染色实验中发现,当Survivin不能结合H3pT3时,中期染色体着丝粒区的H2ApT120信号有所增强,而且,Aurora B不再富集于内层着丝粒区,而是定位于靠近两侧动粒的外层着丝粒区。此外,伴随着Aurora B从内层着丝粒向两侧外层着丝粒区的移位,纺锤体检查点信号通路相关蛋白在动粒区的定位及磷酸化水平发生了一系列改变。这些实验现象提出了一个显而易见的问题:Survivin突变体细胞中的这些表型与Aurora B在着丝粒区的移位有何联系?
进一步的机理分析发现,Survivin突变体细胞中Aurora B在外层着丝粒区的定位依赖于H2ApT120与Sgo1蛋白的结合。当在这些细胞中破坏H2ApT120与Sgo1的结合时,Aurora B不再富集于着丝粒区,纺锤体检查点得以正常沉默并使得姐妹染色单体及时分离,但染色体错误分离的频率却显著上升了。
这一系列实验结果显示,H3pT3和H2ApT120可以分别独立地招募Aurora B至着丝粒的内层和外层区域,而且H2ApT120招募的Aurora B可以相当程度地代偿依赖于H3pT3的Aurora B的丧失。如图4所示,作者们认为,当H3pT3通路受损时,H2ApT120通路会招募更多的Aurora B至外层着丝粒区,并通过磷酸化Knl1的RVSF基序抑制蛋白磷酸酶PP1对纺锤体检查点的沉默作用,进而延迟姐妹染色单体的分离,给予Aurora B更多的时间纠正动粒与微管间的错误连接。
这项研究成果不仅解析了不同组蛋白的磷酸化修饰协同调控Aurora B在着丝粒区定位的分子机制,而且揭示了着丝粒区Aurora B对于染色体分离保真度的重要性。论文的其中一位匿名评审专家评论道:“This is a very interesting manuscript that contains an impressive amount of work. Taken at face value, the results will really help to advance the field. In particular, the fact that the kinetochore Aurora B pool has been so nicely dissected is important because understanding how this pool is regulated to control tension-sensing is currently a major focus of many groups.”。
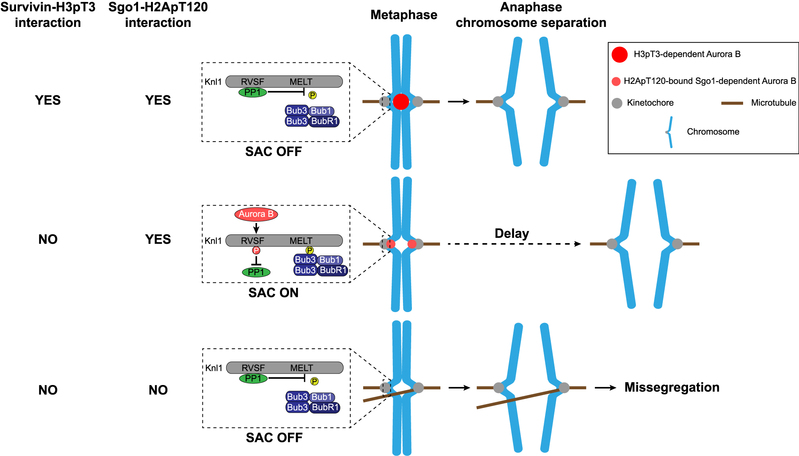
图4:论文所揭示的Aurora B在着丝粒区定位的机制及功能。
汪方炜实验室的博士生梁材和张振蕾为论文的共同第一作者,汪方炜教授是论文的通讯作者。该研究工作得到了国家重点研发计划、国家基金委优秀青年科学基金、英国皇家学会牛顿高级学者基金、浙江省杰出青年科学基金和重点基金、浙江大学校长专项科研基金等的资助。




