2021年2月18日郭行实验室在Oncogene在线发表题为“Proteasome regulation by reversible tyrosine phosphorylation at the membrane”的研究论文,首次揭示了酪氨酸磷酸化参与调控膜定位蛋白酶体的机制,为基于酪氨酸激酶抑制剂的抗癌治疗提供了新的思路。
26S蛋白酶体负责降解真核细胞中绝大多数的蛋白,与几乎所有的生命活动密切相关。 越来越多的证据表明,磷酸化修饰对调控蛋白酶体的功能发挥重要作用。质谱数据显示,人类蛋白酶体上有100多个酪氨酸(pTyr)磷酸化位点,但人们对其功能和调控还知之甚少。
本研究首次揭示过钒酸钠处理在显著增强蛋白酶体酪氨酸磷酸化的同时也造成蛋白酶体活性降低,说明酪氨酸磷酸化对蛋白酶体功能产生负面影响。进一步的研究结果表明蛋白酶体亚基 Rpt2-Tyr439 位点的磷酸化抑制蛋白酶体的组装,并依赖于 Rpt2 N-肉豆蔻酰化介导的膜定位。多种受体酪氨酸激酶(RTKs)可以通过激活Src上调Rpt2-Y439的磷酸化,影响膜定位蛋白酶体的组装和活性。相反,酪氨酸磷酸酶PTPN2可以去磷酸化Rpt2-pY439并促进蛋白酶体对底物的降解。在Src 高度激活的非小细胞肺癌 H1975 细胞中,Rpt2-Y439F突变明显改变了细胞中多种蛋白对Src抑制剂saracatinib的响应。在体外培养和小鼠成瘤实验中,阻断 Rpt2-Y439 磷酸化削弱了 saracatinib 对癌细胞的生长抑制作用。
本研究发现了新的蛋白酶体激酶和磷酸酶,首次揭示了酪氨酸磷酸化参与调控膜定位蛋白酶体的机制,为临床上酪氨酸激酶抑制剂的有效使用和疗效预测提供了新的见解。
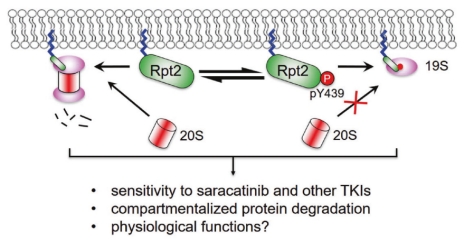
图1 Rpt2-Y439的可逆磷酸化调控26S蛋白酶体的组装和功能。
郭行教授和浙江大学医学院王志萍教授是本文的共同通讯作者,郭行实验室博士生陈露和张雅楠为论文共同第一作者。
原文链接:https://www.nature.com/articles/s41388-021-01674-z




