2021年10月6日,我院冯新华实验室在Science Advances在线发表了题为“HSPA13 Facilitates NF-kB-mediated Transcription and Attenuates Cell Death Responses in TNFa Signaling”的研究论文。
高纯博士(第一作者)和合作伙伴发现了TNFa受体复合体中一个叫做HSPA13的新成员。HSPA13通过直接结合TNFR1以及RIP1,从而稳定了TNFR1-HSPA13-RIP1复合体,促进下游NF-kB介导的转录激活及细胞生存,同时抑制了细胞的程序性死亡(包括凋亡及坏死)。该研究揭示了细胞命运决定中关键的“检查点”机制,对于多效细胞因子TNFa介导的细胞信号转导分流具有重要的理论意义。
RIP1是TNFa信号转导关键的分流因子,其翻译后修饰包括磷酸化和泛素化等调控了它的活性。RIP1依赖于K63泛素化传递NF-kB信号,而其激酶激活则可启动细胞程序性死亡。绝大多数细胞对TNFa的默认响应是NF-kB炎症反应激活,而多项研究亦显示体内同时存在关键的“检查点”限制RIP1启动程序性死亡的能力。冯新华实验室的最新研究通过质谱分析发现了HSPA13与RIP1结合在一起,进一步生化分析发现HSPA13的N端疏水a螺旋结构还介导了它与TNFR1的相互作用。所以,TNFa的刺激可诱导HSPA13招募进入复合体I,而HSPA13作为桥梁稳定了TNFR1-RIP1的结合,并促进RIP1的K63泛素化,进而增强下游NF-aB信号的激活。另一方面,HSPA13可以抑制RIP1从复合体I中脱离,阻断RIP1的胞质活化以及复合体IIa/b的组装,从而抑制RIP1-RIP3-MLKL介导的细胞程序性死亡。HSPA13的缺失促进RIP1从复合体I到复合体II的迁移,显著增强细胞对凋亡、坏死的敏感性。HSPA13促进炎症响应与拮抗细胞死亡的功能也在小鼠模型及斑马鱼模型中得到了证实。
TNFa信号在自身免疫疾病及癌症中都是重要的药物研发靶点。然而,由于TNFa可启动细胞增殖、炎症反应、凋亡以及程序性坏死等截然不同的细胞命运,TNFa相关疗法不可避免的伴随着各种副作用。该研究首次揭示了HSPA13通过调控RIP1在细胞内分布进而精细化调控TNFa信号的机制,为TNFa相关疾病治疗中精准化控制TNFa信号提供了理论基础。
该工作获得国家自然科学基金委重点项目和重大研究计划、浙江省自然科学基金以及“双一流”专项经费的资助和支持。博士后高纯是本文的第一作者。
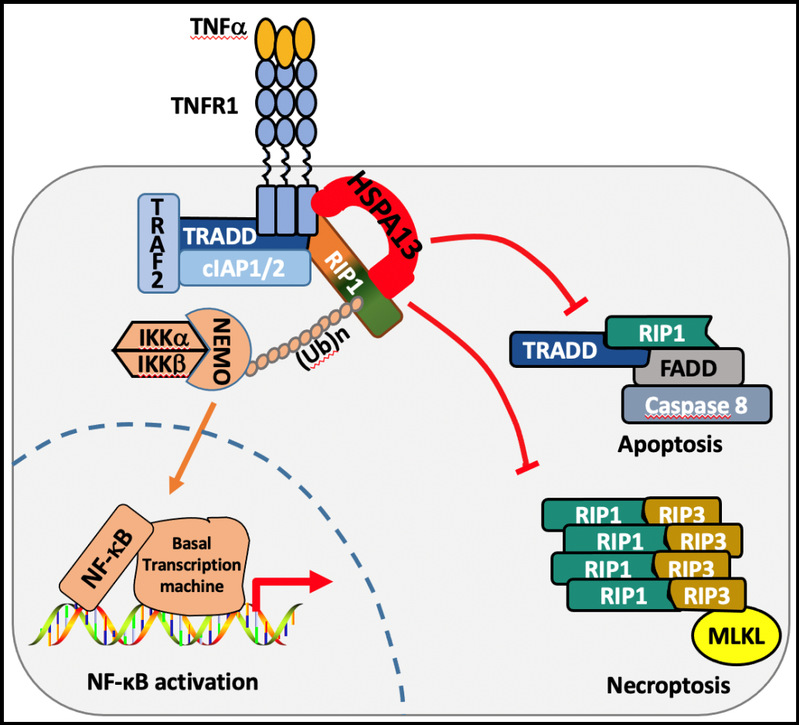
图注:HSPA13调控TNFa信号转导分流的示意图。
细胞因子TNFa结合受体TNFR1后,激活的TNFR1招募多种接头蛋白迅速组装形成锚定在细胞膜的复合体I。而其中HSPA13直接结合TNFR1与RIP1,作为支架蛋白稳定复合体I,促进NF-kB信号的转录激活;同时,HSPA13限制了RIP1的胞质活化,阻断胞质内的复合体IIa/b组装,抑制细胞凋亡及坏死。
原文链接:https://www.science.org/doi/10.1126/sciadv.abh1756




