我院林世贤课题组与北京大学陈鹏/樊新元团队课题组合作在Nature Chemistry上发表题为“Genetically encoded bioorthogonal tryptophan decaging in living cells”的研究论文。该研究开发了一种能在活细胞中“笼锁”和“脱笼解锁”蛋白质中任意色氨酸功能的通用方法(Trp-CAGE,图1)。该方法利用遗传密码扩展技术将“笼锁”色氨酸(Caged Tryptophan)引入目标蛋白的特定位点,实现其功能的暂时屏蔽;然后,利用新发展的生物正交剪切反应在活细胞中完成可控 “脱笼”,实现各类蛋白质家族的精准“激活”和功能解析。通过计算机模型预测,该“色氨酸脱笼”技术可对超过28000个来自不同物种的候选蛋白质进行功能获得性研究。(图1)该工作是林世贤课题组开发的嵌合体翻译系统的另一项代表性应用。
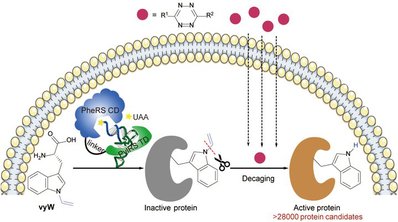
图1、色氨酸“笼锁-脱笼”(Trp-CAGE)策略的示意图
因其独特的结构,色氨酸是蛋白质中介导分子相互作用类型最多、也最“昂贵”的天然氨基酸,其生物合成的“成本”远超其他天然氨基酸,且只由UGG一个密码子编码。由于色氨酸的独特性和稀缺性,色氨酸往往出现在蛋白质的关键位点,稳定蛋白质结构、调节蛋白质构象、调控蛋白质相互作用、参与分子识别和催化等重要过程。如果能够在活细胞内精准操纵特定色氨酸的功能及相互作用,就有望获得一种特异激活含色氨酸蛋白质的通用技术。然而目前尚无对色氨酸进行“可逆化学编辑”的相关报道。该工作发展了一种独特且通用的色氨酸脱笼方法,用于“化学”激活蛋白质特定位点上的色氨酸,以实现相应蛋白质的功能获得性研究。该研究以共轭化学作为设计思路,使用乙烯基作为保护基团,通过共轭吲哚的π系统成功地阻断了色氨酸的几乎所有相互作用类型。这种独特的保护基团可以通过生物正交剪切反应迅速脱除,实现对活细胞内蛋白质的实时、原位激活。更令人兴奋的是,该策略具有广泛的适用性,可以操纵各种不同类型的蛋白质,包括荧光蛋白、金属结合蛋白、激酶、荧光素酶、翻译起始因子和组蛋白翻译后修饰阅读蛋白等。根据计算预测,该策略可以在超过28,000个候选蛋白质上进行生物正交激活调控,展示了其巨大的应用潜力。这一突破为探索和理解蛋白质功能提供了全新的工具。
北京大学博士后朱玉超、我院前博士后丁文龙为论文的共同第一作者,陈鹏教授、林世贤研究员和樊新元副研究员为论文的共同通讯作者。该研究获得了国家重点研发计划、国家自然科学基金、北京市自然科学基金、新基石研究员计划、生物医学峰基金以及博士后创新人才支持计划等项目的资助。
原文链接:https://www.nature.com/articles/s41557-024-01463-7
林世贤实验室聚焦于中心法则的翻译过程,整合交叉学科的研究手段,探索tRNA和蛋白质修饰的生物学功能和工程改造,并致力于开发新型生物医药,用于重大疾病和罕见遗传病的诊疗。欢迎感兴趣的博士后和研究生联系并申请加入,联系邮件sxlin@zju.edu.cn。
实验室链接:http://lsi.zju.edu.cn/25713/list.htm




