我院赵斌实验室在《Hepatology》在线发表了题为“Nuclear KRT19 is a transcriptional co-repressor promoting histone deacetylation and liver tumorigenesis”的研究论文。该研究阐明了肝癌细胞中高表达的细胞骨架蛋白Keratin 19 (KRT19)可以进入细胞核内,通过促进CoREST复合物组装,激活HDAC1的去乙酰化酶活性,进而抑制肝细胞特异性基因表达,促进肝细胞癌去分化的新机制。
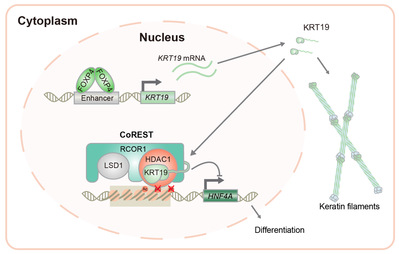
原发性肝癌是全球第四大肿瘤致死病因,目前的治疗手段十分有限。肝细胞癌(hepatocellular carcinoma, HCC,占75%-85%)是最常见的肝癌类型。去分化是HCC发展过程中的一个频发事件,其中一部分HCC细胞会转变成肝癌干细胞并特异表达一些标志基因,如KRT19等。研究表明KRT19阳性的HCC具有更差的预后、更强的转移和耐药性。但KRT19在HCC中是否有功能及其具体机制还不清楚。
利用小鼠体内肝细胞多重基因编辑,赵斌团队证明了KRT19对小鼠肝癌发生具有重要作用。机制研究发现KRT19可以进入细胞核,并通过直接结合组蛋白去乙酰化酶1(HDAC1)和REST辅抑制因子1(RCOR1),进而发挥转录共抑制作用。HDAC1和RCOR1是CoREST(Co-repressor of REST)复合物中两个重要成员。生物化学分析发现KRT19通过促进CoREST复合物的稳定,激活其中HDAC1的去乙酰化酶活性。因此,在高表达KRT19的肝癌细胞中,肝细胞分化相关基因的启动子或增强子区组蛋白乙酰化水平降低。通过这一机制KRT19抑制了肝细胞分化,促进了肿瘤干性,从而促进肝癌发生发展。系统性筛选发现转录因子FOXP4的上调直接诱导了KRT19在肝癌中的异常高表达。此外,在小鼠原发肝癌模型和人肝癌PDX(Patient-derived xenografts)模型上的研究表明HDAC抑制剂可以选择性的抑制KRT19高表达的肝癌。
这一研究证明了KRT19具有一种新的调控组蛋白去乙酰化的活性,并因此在肝癌发生发展过程中起到关键作用。这一研究还为肝癌的精准治疗提示了新的表观遗传学策略。赵斌实验室博士生韩世勋、钟国轩和方东实验室博士生樊浩楠为本文的共同第一作者,通讯作者为赵斌教授。该工作得到了浙江大学生命科学研究院方东研究员、冯新华教授、复旦大学生命科学学院丁琛教授、徐彦辉教授和浙大附属一院梁廷波教授等合作实验室的大力支持。该研究得到了国家自然科学基金、浙江省自然科学基金等资助。
原文链接:https://journals.lww.com/hep/abstract/9900/nuclear_krt19_is_a_transcriptional_co_repressor.832.aspx




