早在1956年,著名生物化学学家Eugene P. Kennedy与他的同事Samuel B. Weiss发现了磷脂合成过程需要胞嘧啶核苷三磷酸(CTP)提供能量[1]。他们纠正了因商业试剂污染而将ATP误认为磷脂合成关键反应能量供体的错误观点[2]。这个开创性发现为后来的脂质代谢通路解析以及脂质功能研究奠定了重要基础。然而,一个长期以来鲜有人关注且尚未解决的问题是,CTP专一性驱动磷脂合成的生物学意义是什么?
2024年7月26日,我院叶存奇课题组在Nature Chemical Biology在线发表了题为“Phospholipid biosynthesis modulates nucleotide metabolism and reductive capacity”的研究论文,详细阐明了CTP在磷脂合成过程中发挥的重要代谢调节作用。
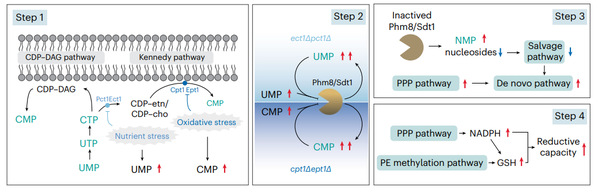
根据CTP对磷脂前体代谢物的选择,细胞具备两种策略来添加磷脂头部基团。一种策略是CTP直接激活水溶性前体,如胆碱或者乙醇胺,进而与甘油二酯(DAG)结合,生成细胞内最丰富的两种磷脂:磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)。这一通路因Eugene P. Kennedy而命名为Kennedy通路。另一种策略是CTP激活脂溶性前体磷脂酸(PA),将其转变为胞嘧啶核苷二磷酸-甘油二酯(CDP-DAG),这种激活态的脂质可以与多种头部基团前体代谢物反应,合成不同种类磷脂。
本项研究中,作者以真核模式生物酿酒酵母为研究模型,发现CTP在参与磷脂合成过程时,自身实现了循环回收,为细胞提供了一种监测嘧啶回收能力的手段;细胞通过选择不同CTP策略的磷脂合成通路可以协调核苷酸合成与回收代谢的平衡,改变磷酸戊糖的生成需求,进而影响了还原性代谢物的合成,从而改变细胞的氧化还原平衡状态。具体而言,作者发现Kennedy通路的缺陷将导致激活态胆碱和乙醇胺(CDP-choline/CDP-ethanolamine)在胞内发生数以百倍的积累,并会限制了嘧啶核苷酸的再利用。在核苷酸酶的底物抑制效应下,Kennedy通路缺陷促使细胞激活补偿机制,进行从头核苷酸合成。这种依赖于磷酸戊糖途径的从头核苷酸合成促进了还原型辅酶NADPH的产生,进一步提升谷胱甘肽合成;同时,Kennedy通路的缺陷会让细胞更依赖于PE甲基化的过程来合成PC,而这一反应所具备的甲基吸收池(methyl sink)功能也将协调促进谷胱甘肽的合成[3, 4]。
值得强调的是,尽管Kennedy通路的缺陷引发了广泛且显著的代谢重编程,作者发现细胞在基因转录层面几乎没有受到任何影响。这说明磷脂合成对细胞代谢的重塑能力是可以独立于转录调控。
在细胞生理层面,作者观察到Kennedy通路的最后一步以及倒数第二步骤的反应活性分别对氧化压力和胆碱匮乏敏感,反映了在氧化或营养压力条件下,细胞可以通过Kennedy这一磷脂合成通路来响应并应对环境压力。这一策略将磷脂合成对生物膜的调节功能与细胞代谢感知整合了起来,有助于细胞更好的适应环境变化。作者还发现Kennedy通路在衰老细胞中受到抑制,突显了其在老化细胞内激活抗氧化防御机制的重要作用。这些发现强调了磷脂合成能够整合对核苷酸代谢、氧化还原平衡以及膜生物物理特性的调节能力,并以此在细胞防御中发挥关键作用。从疾病的角度来看,由于膜磷脂和核苷酸的代谢失衡在众多重大疾病中十分常见,磷脂代谢所兼备的代谢调节能力很可能在生命健康、疾病发生和衰老过程中均发挥了关键作用。
我院博士研究生朱羿冰、博士后仝小孟、博士研究生薛静远为本论文共同第一作者,浙江大学叶存奇研究员为通讯作者。浙江大学生命科学研究院博士研究生邱宏、浙江大学医学院附属妇产科医院张丹教授、浙江大学海洋学院、海南研究院郑道琼教授、江西师范大学涂宗财教授等为该研究提供了重要支持。
参考文献:
1.Kennedy, E.P. and S.B. Weiss, The function of cytidine coenzymes in the biosynthesis of
phospholipides. J Biol Chem, 1956. 222(1): p. 193-214.
2.Wickner, W.T., Eugene Patrick Kennedy, 1919-2011. Proc Natl Acad Sci U S A, 2011. 108(48): p.
19122-3.
3.Ye, C., et al., A Metabolic Function for Phospholipid and Histone Methylation. Mol Cell, 2017.
66(2): p. 180-193 e8.
4.Fang, W., et al., Reciprocal regulation of phosphatidylcholine synthesis and H3K36 methylation
programs metabolic adaptation. Cell Rep, 2022. 39(2): p. 110672.
原文链接:https://doi.org/10.1038/s41589-024-01689-z




