2024年9月10日,我院冯新华实验室在Cell Reports上发表题为“Starvation-induced phosphorylation activates gasdermin A to initiate pyroptosis”的研究论文。该研究阐明了介导细胞焦亡的gasdermin家族的成员GSDMA在细胞饥饿条件下被磷酸化激活的机制,并通过动物实验表明该细胞焦亡通路可抑制食道肿瘤生长与恶化(图1)。
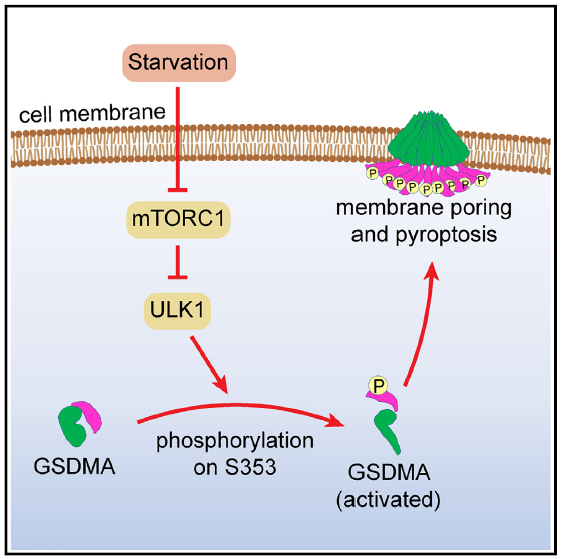
图1. GSDMA在细胞长时间饥饿条件下可被活化的ULK1激酶磷酸化其353位点的丝氨酸,
解除分子内自抑制并在细胞膜表面形成穿孔介导细胞焦亡。
细胞焦亡是一种炎症性的程序性死亡机制,在哺乳动物中通常作为免疫激活机制在抵御病原体及拮抗肿瘤中发挥重要作用。近年的研究表明,细胞焦亡是由gasdermin蛋白家族成员所介导的,该蛋白家族共有五个成员,其N端结构域在激活后可以寡聚化并在细胞膜上形成直径十几纳米的孔洞,破坏细胞膜半透性并导致细胞死亡。在这五个成员中,GSDMB,GSDMC,GSDMD,GSDME均被发现可通过酶切释放其N端结构域激活,但目前GSDMA的生理条件下的激活机制尚未被报导。本研究发现,在细胞氨基酸饥饿且ATP严重消耗的条件下,细胞内响应饥饿的磷酸激酶ULK1被激活,并导致GSDMA的353位点的丝氨酸磷酸化。磷酸化后的GSDMA丧失了其C端对N端结构域的自抑制作用,导致GSDMA被激活、寡聚化并介导细胞焦亡。在胃肿瘤细胞系中敲除GSDMA后的小鼠原位成瘤实验中,GSDMA敲除细胞系其肿瘤生长更迅速,且更快导致宿主小鼠的死亡,表明GSDMA具备抑制胃癌发展与恶化的作用。此外,持续性激活的GSDMA会导致小鼠的皮肤炎症及免疫浸润,提示GSDMA参与皮肤系统的免疫响应。本研究首次揭示了内源激活GSDMA的分子机制,并且表明非蛋白剪切的翻译后修饰亦可作为GSDM蛋白家族的激活机制。此外,本研究的结果对胃癌及皮肤炎症的防治也具有潜在的推动作用。
李欣然博士(浙江大学杭州国际科创中心研究员,原我院青年研究员)与李潇(博士研究生)为论文的共同第一作者。该研究获得了国家重点研发计划、国家自然科学基金、浙江省自然科学基金、国家博士后人才引进项目以及中国博士后科学基金等项目的资助。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(24)01079-9




