2024年9月20日,我院徐平龙实验室在The EMBO Journal上发表了题为“TBK1-Zyxin signaling controls tumor-associated macrophage recruitment to mitigate antitumor immunity”的研究论文。该工作通过鉴定TBK1-Zyxin信号轴,阐释了核酸免疫识别调控细胞粘附与运动能力的新型功能和作用机制,并阐明了以往未知的核酸识别促进肿瘤相关巨噬细胞(TAMs)募集以及抑制抗肿瘤免疫的病理功能。
由TAM驻留而构成的抑制性免疫肿瘤微环境中肿瘤治疗的重要障碍之一。核酸天然免疫识别是机体感知组织损伤和抵抗外源病原入侵的关键免疫信号机制,在宿主防御、肿瘤免疫、器官纤维化、自身免疫性疾病、神经退行性疾病中具有重要功能,但核酸识别是否可以直接调控巨噬细胞机械运动等基本功能目前还鲜有研究,对肿瘤微环境中肿瘤相关巨噬细胞粘附与运动的调控机制也尚未明晰。徐平龙实验室发现,核酸识别信号激活时巨噬细胞粘附增加而运动能力下降,通过对分子机制和细胞功能进行探究,首次明确了cGAS-STING和RLR-MAVS信号通路下游关键激酶TBK1可以直接结合肌动蛋白动力学的关键调节因子Zyxin,调控其S143位点磷酸化,促进Zyxin蛋白在细胞焦点粘附上的募集,并因此调控巨噬细胞的粘附与运动功能。这一机制在体内肿瘤相关巨噬细胞中得到明确验证,而肿瘤微环境中激活cGAS-STING能够显著促进肿瘤相关巨噬细胞中Zyxin S143位点磷酸化信号。在小鼠模型中,利用遗传学或药理学手段抑制TBK1-Zyxin信号轴则可显著降低CD11b+ F4/80+肿瘤相关巨噬细胞的浸润并以此增强抗肿瘤免疫。Zyxin敲除能够显著增强anti-PD-1在小鼠皮下黑色素瘤中介导的抗肿瘤免疫疗效。
以上研究首次揭示了核酸识别在传统的病原识别与免疫激活功能外,还具有调控巨噬细胞粘附与运动的新型生物学功能。研究提出并验证了TBK1-Zyxin这一关键分子路径,并在黑色素瘤模型中探究了该机制对肿瘤相关巨噬细胞驻留的调控作用以及抗肿瘤免疫的负面影响。该发现将为理解肿瘤免疫的复杂进程以及相关治疗技术的发展提供新的药物靶点及理论依据。
实验室博士后周如苑,博士生王梦秋,李潇为论文共同第一作者,徐平龙教授为通讯作者。该研究工作得到了王晓健教授、邹键教授、梁廷波教授、冯新华教授、邵建忠教授、夏冰教授、Dante Neculai教授、章琦教授等合作者的大力支持。研究受国自然创新研究群体、重点项目、杰青项目、科技部重点研发计划、青年基金等资助,在浙江大学开展并完成。
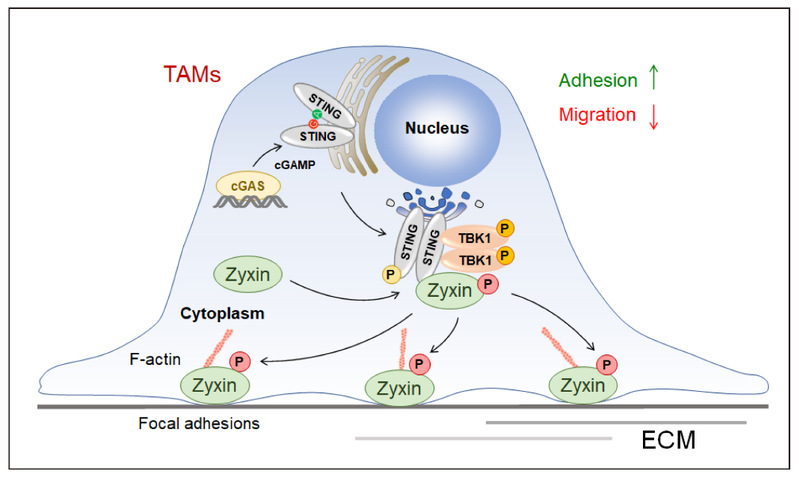
图:TBK1-Zyxin信号调控肿瘤相关巨噬细胞募集及抗肿瘤免疫
原文链接:https://www.embopress.org/doi/full/10.1038/s44318-024-00244-9




