2024年11月11日,我院番文春课题组在微生物学旗舰刊物《PLOS Pathogens》发表题为“TRIM32 inhibits Venezuelan equine encephalitis virus infection by targeting a late step in viral entry”的研究论文,鉴定了宿主E3泛素连接酶TRIM32作为一个新颖的甲病毒限制因子。

番文春课题组聚焦人重要RNA病毒与宿主互作机制研究,课题组建立新颖的病毒—宿主互作研究体系(阵列CRISPR、ORF文库和邻近标记联合蛋白质谱等)来挖掘调控病毒感染的关键宿主因子,结合病毒学、细胞生物学、分子生物学与生物化学等研究手段揭示其分子机制,利用动物或类器官模型揭示宿主因子与病毒感染致病的体内相关性。
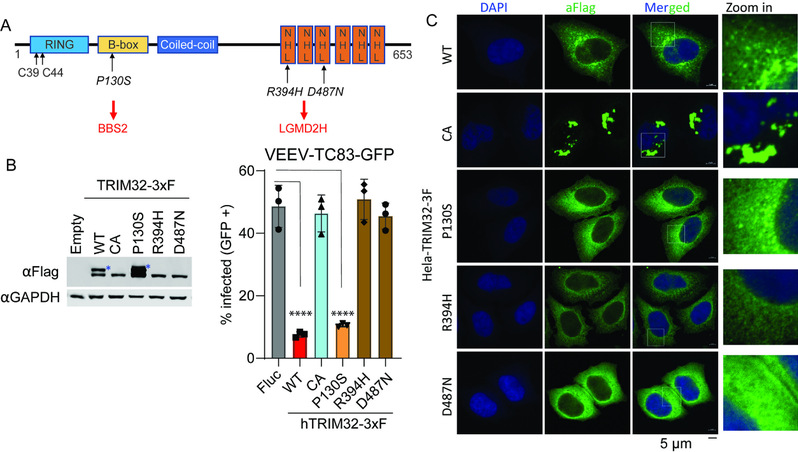
在本研究中,利用课题组建立的“双色荧光流式细胞筛选”策略,分析了118个人RING型E3泛素连接酶对一种由蚊子传播的致脑炎甲病毒——委内瑞拉马脑炎病毒(Venezuelan equine encephalitis virus vaccine strain TC83, VEEV-TC83,人畜共患,尚无FDA批准的疫苗或特异性抗病毒药物)复制的影响,鉴定到TRIM32作为一个新颖的甲病毒(Alphavirus)宿主限制因子。研究中发现TRIM32可抑制多种蚊媒传播甲病毒的复制,包括辛德毕斯病毒(SINV,引起脑炎)和阿良良病毒(ONNV,引起关节炎),而对寨卡病毒(ZIKV,蚊子传播)和柯萨奇病毒B3(CVB3,肠道病毒,粪口传播)无抑制作用。分子机制探索中发现TRIM32对VEEV-TC83的抑制作用不依赖TRIM32-STING-IFN抗病毒信号通路,而是特异性靶向病毒进入细胞后脱衣壳(uncoating)到病毒蛋白翻译的过程,但具体分子细节仍待解析。值得注意的是,研究中还发现TRIM32的病理突变体R394H和D487N(与肢带型肌营养不良症2H型相关)丧失了对甲病毒的抑制功能,且该表型与TRIM32的单泛素化修饰存在重要关联(见下图所示)。未来相关动物模型的建立将有助于探究TRIM32病理突变与甲病毒感染致病的体内相关性。总之,该研究丰富了我们对宿主泛素蛋白酶体系统与病毒相互作用的认识。
番文春课题组博士研究生谢逸凡、曹婕和甘淑仪为共同第一作者,番文春研究员和UT Southwestern Medical Center John W. Schoggins博士为共同通讯作者。本研究受国家自然科学基金、浙江大学生命科学研究院启动经费、浙江大学基本科研业务费的资助(项目负责人:番文春)。课题组成员钱苏红博士、博士研究生张东杰,浙江大学实验动物中心徐令东博士、浙江大学医学院第二附属医院徐峰博士、清华大学医学院丁强博士对本项目提供重要支持和协助;感谢浙江大学生命科学研究院生物成像平台和清华大学蛋白质化学与组学平台的支持。
原文资源和连接:PMID: 39527628, PMCID: PMC11581401, DOI: 10.1371/journal.ppat.1012312




