我院姬峻芳实验室于Nature communications在线发表题为“Liver-specific Gene PGRMC1 Blocked c-Myc-Induced Hepatic Carcinogenesis through Promoting ER Stress-independent PERK Activation”的研究论文。该研究揭示肝脏特异基因(Liver specific genes, LSGs)的低表达与肝细胞癌(Hepatocellular carcinoma, HCC)的较差预后和c-Myc信号通路的高度激活相关。在与c-Myc和患者预后相关的排名前五个LSGs中,PGRMC1最显著地阻断了c-Myc诱导的原位HCC形成。机制上,PGRMC1通过其内质网腔内结构域和PERK内质网腔内结构域发生相互作用,以ER应激非依赖的方式激活PERK,磷酸化eIF2α,从而抑制c-Myc蛋白翻译,进而阻断c-Myc诱导的肝癌发生。
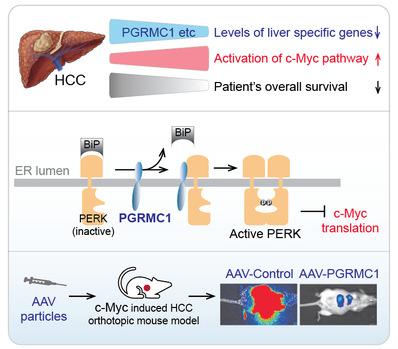
图1. 肝特异性基因和PGRMC1在调节HCC中的作用
HCC约占所有原发性肝癌的90%,是全球癌症相关死亡的第四大原因。LSGs是一组与人体其他器官相比在肝脏中特异性高表达的基因,与肝脏代谢功能有关。它们是肝脏终末分化的标志物,参与肝脏的基本和独特代谢功能。LSGs在HCC肿瘤中通常表达失调,但其在调节HCC发生和进展中的作用研究较少。
由此,姬峻芳实验室整合分析了三个独立队列中718名HCC患者非肿瘤和肿瘤组织中759个肝脏特异基因的转录组学数据。发现与HCC患者的非肿瘤肝组织相比,这些LSGs的表达水平在肿瘤中大多降低,且LSGs的低表达与肝细胞癌患者的较差预后和c-Myc信号通路的高度激活相关。进一步筛选与c-Myc激活呈负相关的前五个LSGs,发现其中PGRMC1最显著地抑制了c-Myc诱导的高压尾静脉注射(Hydrodynamic tail vein injection,HDTVi)HCC小鼠模型的发生发展。在HCC患者中,肿瘤组织中PGRMC1水平显著降低,且PGRMC1的低表达与肝细胞癌患者的较差预后和c-Myc信号通路的高度激活相关。进一步的分子机制研究发现,在内质网中,PGRMC1通过其内质网腔内结构域与PERK内质网腔内结构域相互作用,这种相互作用会破坏BiP和PERK的相互作用,以不依赖内质网应激的方式激活PERK,磷酸化eIF2α,从而抑制c-Myc蛋白翻译和c-Myc诱导的肝癌发生。此外,本研究还发现,PGRMC1的内质网定位及其N端在抑制c-Myc蛋白翻译和c-Myc诱导的肝癌发生中发挥重要作用,使用野生型PGRMC1或N端1-47氨基酸的腺相关病毒治疗c-Myc诱导的HCC小鼠会显著延长小鼠的存活时间。
总之,本研究发现LSGs在HCC肿瘤中异质性表达,并且通常在HCC肿瘤组织中表达下调,LSGs低表达的HCC病人预后不良,c-Myc信号通路显著激活;其中LSG PGRMC1具有最强的抑制c-Myc信号通路激活和在体内阻断c-Myc诱导的原位HCC能力。PGRMC1以内质网应激非依赖的方式激活PERK,从而抑制c-Myc蛋白翻译。研究结果表明LSGs对HCC患者c-Myc信号通路激活具有重要作用,在c-Myc信号通路激活的HCC患者中恢复PGRMC1表达或者其N端1-47氨基酸表达,或将使该部分患者生存获益。
姬峻芳实验室已毕业博士姬付博、博士后张剑娟和博士生毛立平为共同第一作者,姬峻芳教授为通讯作者。该研究获得了国家自然科学基金、国家重点研发计划、浙江省“尖兵”和“领雁”研发攻关项目、中央高校基本科研业务费专项资金项目和浙江大学-绍兴大学和绍兴研究院联合研究计划等资助。
原文链接:https://www.nature.com/articles/s41467-024-55745-2




