我院苏文静课题组与药学院谢伟课题组合作,于Nature Chemical Biology杂志在线发表题为Plasma membrane–associated ARAF condensates fuel RAS-related cancer drug resistance的研究长文。该研究解析了ARAF亚型特异性功能背后一个此前未被认识到的分子基础,揭示了ARAF对RAS活性的调控在病理条件下的生物学功能,为靶向该通路的异常调控提供新思路和科学依据。
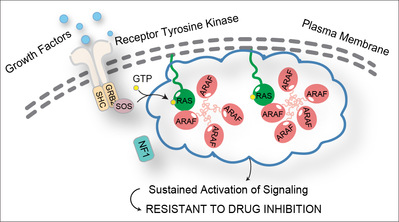
图1. ARAF通过其N端无序区介导的凝聚体来维持RAS活性并促进肿瘤耐药
RAS-RAF-MAPK通路是多种膜受体传导的生长信号跨膜传递的交汇点,参与细胞的增殖、分化、凋亡、炎症反应等多种生理过程。处于持续激活状态下的RAS-RAF-MAPK通路通常会造成细胞增殖或分化异常,因此,该通路中各成员蛋白的突变和异常表达与多种恶性肿瘤的发生发展密切相关。作为该通路的核心传导因子,RAF蛋白有三个异构体,分别为ARAF、BRAF和CRAF。目前,大量研究都集中在BRAF和CRAF功能及突变体分析上,而ARAF的生物学功能却鲜为人知。
因此,苏文静课题组研究人员通过比较三个RAF蛋白的亚细胞定位,观察到ARAF表现出明显的细胞膜定位,并且在细胞膜附近呈现出不均匀的类胶状聚集。进一步确定与ARAF特异性膜定位相关的结构域,研究人员发现ARAF的N端18个氨基酸组成的无序区介导了ARAF-RAS凝聚体的形成。这些凝聚体可以导致细胞膜局部RAS浓度上升,保护RAS-GTP免受GTPase活化蛋白(GTPase activating protein,GAP)依赖的负向调控,同时放大受体酪氨酸激酶(Receptor tyrosine kinase,RTK)等细胞表面受体触发的RAS激活。通过这一机制,ARAF凝聚体在细胞内的丰度决定了RAS-GTP水平以及对RAS信号通路抑制剂的敏感性。值得注意的是,在携带RAS突变的肿瘤细胞中,泛RAF抑制剂能够有效抑制ARAF N端缺失细胞的增殖,而表达野生型ARAF的亲代细胞则对治疗表现出耐药性。此外,在激素依赖型肿瘤中,ARAF-RAS凝聚体能够促进RAS依赖的内分泌治疗耐药。
这一发现对于肿瘤靶向治疗来说具有重要意义,它揭示了ARAF的一种新型致癌机制:通过其N端介导ARAF-RAS凝聚体的形成导致RAS的持续性激活。这意味着ARAF可能成为逆转肿瘤耐药的关键治疗靶点。但需要强调的是,ARAF促进RAS活性的功能不依赖于激酶活性,而目前针对RAF蛋白的广谱抑制剂主要基于激酶活性或RAF二聚化来进行设计。因此,这些抑制剂不会对ARAF功能起到有效抑制。鉴于ARAF在维持RAS-GTP水平以及RAS蛋白重激活中的关键作用,通过降解ARAF诱导的凝聚体或使用调节凝聚体形成的小分子化合物,可能为解决野生型和突变型ARAF介导的肿瘤耐药提供新的希望。
苏文静实验室博士研究生李雯、施潇娴及谢伟实验室博士研究生谭采薇为共同第一作者。苏文静研究员和谢伟研究员为论文共同通讯作者。该研究获得了国家自然科学基金、国家重点研发计划、中央高校基本科研业务费专项资金项目等资助。
原文链接:https://www.nature.com/articles/s41589-024-01826-8




