胞质中母源性mRNA降解和翻译的精确调控对于维持哺乳动物卵母细胞成熟过程至关重要。近年来的研究发现RNA转录后修饰参与调控pre-mRNA剪接、转运出核、稳定性维持、降解以及翻译等环节[1]。其中, N4-乙酰胞嘧啶核苷(N4-acetylcytidine)修饰是仅次于m6A和ψ修饰之外丰度较高的修饰类型,其由N乙酰基转移酶10(NAT10)催化产生[2],然而关于mRNA上ac4C修饰的建立、具体发挥何种生理功能以及调控机制还研究较少。尤其是ac4C等新型RNA修饰如何在转录后层面调控mRNA的降解和翻译过程还有待系统深入研究。
2025年2月21日,我院范衡宇教授团队在Science Advances杂志上发表了题为“NAT10-mediated mRNA N4-acetylation is Essential for the Translational Regulation During Oocyte Meiotic Maturation in Mice”的研究论文。该研究开发了低起始量、高灵敏度的mRNA ac4C新型检测技术——ac4C LACE-Seq,基于该技术鉴定了小鼠GV卵母细胞中ac4C修饰位点,并报道了ac4C修饰通过促进关 键母源mRNA的翻译以驱动卵母细胞减数分裂成熟过程。
此前,全转录组水平检测ac4C修饰的主要方法有基于ac4C抗体的acRIP-Seq技术[3],基于硼氢化钠及其衍生物在酸性条件下可以还原ac4C修饰所开发的ac4C-Seq技术[4],然而这两种技术对mRNA的起始量要求都在微克以上,限制了在生殖细胞、早期胚胎等微量样本中的应用。因此,开发高灵敏度、低起始量、单碱基分辨率的ac4C测序技术对于各领域深入研究ac4C修饰在生理和病理情况下的动态变化以及调控机制至关重要,这也是该领域的技术瓶颈。该研究在先前报道的LACE-seq技术[5]的基础上优化和改进了关键步骤,建立了一种低投入量高灵敏度的ac4C LACE-seq技术,并在50颗小鼠GV期卵母细胞中鉴定到8241个ac4C修饰位点,且同一关键母源mRNA上ac4C修饰信号比先前2000颗卵母细胞acRIP-seq [6]测序检测到的信号更强。同时,该研究还利用NAT10 LACE-seq同步鉴定了GV期卵母细胞中NAT10结合的mRNA,联合分析发现两个抗体捕获到的peaks具有较高的重叠性,且ac4C peaks和NAT10 binding peaks均主要分布在CDS和5’-UTR区域,其Motif也与之前报道的ac4C 修饰Motif相一致,进一步佐证了该技术的可靠性(图1)。
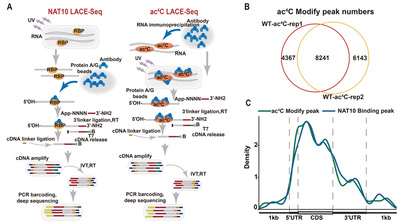
图1:利用ac4C LACE-seq技术鉴定卵母细胞母源转录本上ac4C修饰。A: NAT10 LACE-seq (左) and ac4C LACE-seq (右)技术流程图。B:利用ac4C LACE-seq在GV卵母细胞两个生物学重复中鉴定到共有的8241个ac4C修饰位点。C:ac4C修饰peaks和NAT10结合peaks在转录组上的分布模式。
为了研究关键母源mRNA 上ac4C修饰具体发挥何种生理功能,该研究利用Gdf9-Cre构建了从原始卵泡中开始特异性敲除Nat10的小鼠模型,表型分析发现Nat10缺失造成了严重的卵母细胞减数分裂成熟缺陷并最终导致雌性不孕。利用ac4C LACE-seq对Nat10条敲小鼠GV卵母细胞进行测序,结果显示Nat10缺失造成卵母细胞mRNA上ac4C修饰不能正常建立。进一步联合转录组和翻译组数据分析发现Nat10缺失后差异表达的基因与携带ac4C修饰的基因之间并无显著重叠,但携带ac4C修饰的基因,如关键母源因子BTG4的转录本,在Nat10缺失后其翻译效率显著降低。进一步通过HPG 整体翻译活性检测、Btg4和Ccnb1翻译活性报告载体注射、体外转录过程中掺入乙酰化CTPs(ac4CTPs)构建富含ac4C修饰的Zar1 mRNA、构建定点突变Msy2和Zar1 mRNA潜在ac4C修饰位点以模拟ac4C修饰消除的mRNA,显微注射后通过荧光示踪和定量测定mRNA在卵母细胞中的翻译效率。结果显示, ac4C (+)转录本的蛋白翻译水平高于ac4C (-)转录本,ac4C修饰位点突变的转录本蛋白翻译水平显著降低。多角度系统证明了ac4C 修饰对于维持卵母细胞成熟过程中母源mRNA的翻译活性至关重要(图2)。
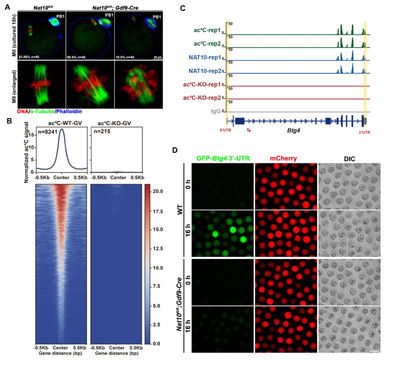
图2:Nat10条敲小鼠卵母细胞中母源mRNA上ac4C修饰降低并导致翻译效率显著降低。A: Nat10缺失造成严重的减数分裂成熟缺陷。B:ac4C LACE-seq结果显示Nat10缺失后整体ac4C修饰水平显著降低。C:关键母源基因Btg4 mRNA上ac4C修饰信号在Nat10条敲小鼠卵母细胞中几乎完全消失。D:Nat10条敲小鼠卵母细胞成熟过程中GFP-Btg4 3’-UTR 报告载体翻译活性显著降低。
综上,该研究开发了一种低起始量高灵敏度的ac4C LACE-seq技术,并鉴定了小鼠GV卵母细胞中mRNA ac4C修饰位点。揭示了NAT10介导的ac4C修饰通过增强母源mRNA的翻译效率来精确调控卵母细胞减数分裂成熟过程(图3),为ac4C修饰发挥重要生理功能提供了直接的遗传学证据。此外,本研究开发的ac4C LACE-seq技术将为其他领域,尤其是在珍贵的微量样本中研究ac4C修饰功能和机制提供方法学借鉴,为其他类型mRNA修饰测序技术的开发提供新的思路。
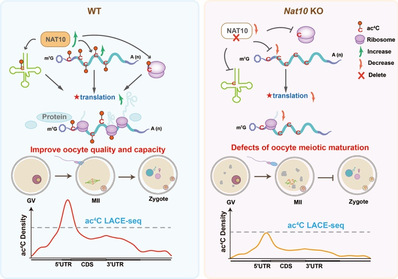
图3:NAT10介导的ac4C修饰通过增强mRNA翻译效率进而调控卵母细胞成熟机制模式图。
范衡宇组已毕业博士生陈露、在读博士生王文静、吴雨珂,科研助理刘绍源以及广东省第二人民医院副研究员苏瑞宝博士为论文共同第一作者。该研究受到科技部重点研发计划、国家自然科学基金、浙江省自然科学基金以及“博新计划”的资助。
延伸阅读:
范衡宇教授团队近年来聚焦NAT10与ac4C修饰的生理功能和相关调控机制研究,此前的工作分别报道了ac4C整体修饰丰度在不同组织以及精子发生过程中的动态变化,以及NAT10在小鼠精原细胞分化及减数分裂前期进程中的生理功能和调节机制(Nucleic Acids research, 2022)。揭示了NAT10 介导的mRNA ac4C 修饰维持卵泡发育和卵巢功能,提出ac4C的形成和动态调控是决定卵泡发育突破次级卵泡阶段的重要分子指标(Science Bulletin,2024)。鉴定了PCBP1/2和TDP43三种RNA结合蛋白作为哺乳动物细胞中协助NAT10在mRNA上建立ac4C修饰的Adaptors蛋白(Advanced Science, 2025)。最近的这一工作开发了低起始量高灵敏度的mRNA ac4C新型检测技术——ac4C LACE-Seq,并报道了ac4C修饰通过促进关键母源mRNA的翻译效率以驱动卵母细胞减数分裂成熟过程的机制(Science Advances, 2025)。此外,各种RNA中发生的ac4C修饰是由何种蛋白去识别和阅读的,识别和阅读后通过何种机制影响生物体的生理功能?生物体内是否存在ac4C特异性的主动去乙酰化机制来将已发生的ac4C修饰擦除?ac4C修饰的建立和擦除之间是否存在动态平衡?这些问题都有待深入研究。
原文链接:https://www.science.org/doi/epdf/10.1126/sciadv.adp5163
参考文献:
1.Roundtree IA, Evans ME, Pan T, He C: Dynamic RNA Modifications in Gene Expression Regulation. Cell 2017, 169(7):1187-1200.
2.Karthiya R, Wasil SM, Khandelia P: Emerging role of N4-acetylcytidine modification of RNA in gene regulation and cellular functions. Mol Biol Rep 2020, 47(11):9189-9199.
3.Arango D, Sturgill D, Alhusaini N, Dillman AA, Sweet TJ, Hanson G, Hosogane M, Sinclair WR, Nanan KK, Mandler MD et al: Acetylation of Cytidine in mRNA Promotes Translation Efficiency. Cell 2018, 175(7):1872-1886 e1824.
4.Sas-Chen A, Thomas JM, Matzov D, Taoka M, Nance KD, Nir R, Bryson KM, Shachar R, Liman GLS, Burkhart BW et al: Dynamic RNA acetylation revealed by quantitative cross-evolutionary mapping. Nature 2020, 583(7817):638-643.
5.Su R, Fan LH, Cao C, Wang L, Du Z, Cai Z, Ouyang YC, Wang Y, Zhou Q, Wu L et al: Global profiling of RNA-binding protein target sites by LACE-seq. Nat Cell Biol 2021, 23(6):664-675.
6.Jiang X, Cheng Y, Zhu Y, Xu C, Li Q, Xing X, Li W, Zou J, Meng L, Azhar M et al: Maternal NAT10 orchestrates oocyte meiotic cell-cycle progression and maturation in mice. Nat Commun 2023, 14(1):3729.




