转录因子NF-κB在免疫、炎症和胁迫应激反应中起着关键作用,它与癌症、自身免疫性疾病和神经退行性疾病也有着密切关系。在白介素1介导的NF-κB信号通路激活过程中,泛素连接酶TRAF6与泛素结合酶Ubc13/Uev1A共同催化合成K63连接的自由多泛素链,后者作为“第二信使”直接激活下游蛋白激酶TAK1。在此过程中,怎样形式的自由多泛素链介导了TAK1的激活,TRAF6又是怎样高效合成大量自由多泛素链信号分子的?这些重要的问题需要进一步的解答。
生命科学研究院夏总平实验室通过建立体外泛素化合成系统,分离纯化了不同长度的K63自由多泛素链。通过体外TAK1激酶激活实验,发现只有长的多泛素链才能介导TAK1的激活。深入的结构-功能分析鉴定到Coiled-coil (CC)结构域对TRAF6持续高效合成多泛素链至关重要。进一步的催化机制分析阐明了TRAF6合成自由多泛素链的具体生化机制,提出了TRAF6工作的全新模型:CC结构域一方面介导了TRAF6的寡聚化,迫使结合的Ub~Ubc13相互靠近,赋予TRAF6高效酶活;另一方面,CC结构域自身寡聚化后也结合大量的Ubc13/Ub~Ubc13,进一步赋予TRAF6持续高效合成长多泛素链的酶活。
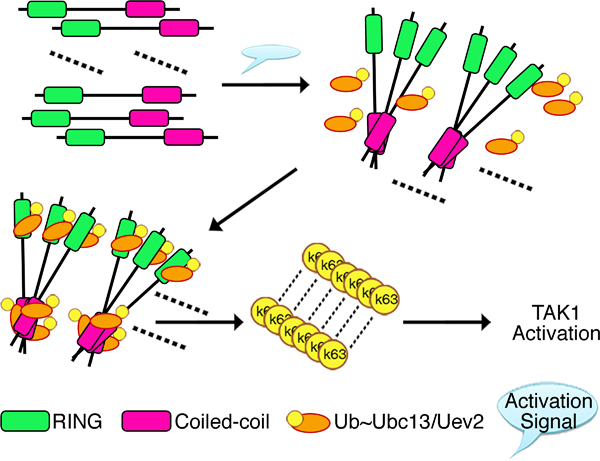
图 TRAF6高效合成自由多泛素链的分子机制
本文的第一作者为胡林博士,许嘉锋、谢晓梅、周逸文和陶攀峰等同学也做出了重要贡献,通讯作者为夏总平教授。该研究得到了国家自然科学基金委、科技部、浙江省杰青基金的支持。
原文链接:https://www.nature.com/articles/s41467-017-01290-0




