2018年11月5日,浙江大学生命科学研究院宋海实验室在EMBO Journal在线发表题为“Loss of VGLL4 suppresses tumor PD-L1 expression and immune evasion”的研究论文,阐明VGLL4缺失抑制PD-L1的表达并参与抗肿瘤免疫调控的作用机制。
肿瘤细胞通过多种途径逃避机体的免疫监控与杀伤,导致肿瘤组织快速增殖。其中肿瘤免疫检查点分子PD-L1(又名B7-H1)通路在肿瘤细胞免疫逃逸中发挥着极其重要的作用。PD-L1主要表达在肿瘤细胞,DC (Dendritic Cell),巨噬细胞等。目前的研究主要集中在PD-L1肿瘤细胞中的表达调控。肿瘤细胞PD-L1的表达可以分为持续表达型与诱导表达型。很多癌基因与抑癌通路都参与了PD-L1的持续表达调控,例如EGFR、MYC、PTEN等。因此,这些通路除了参与调控肿瘤细胞的生长,还能够促进肿瘤细胞的免疫逃逸。很多炎症因子、细胞因子可以诱使肿瘤细胞表达PD-L1, 其中IFNγ是已知的最强的诱导PD-L1表达的因子。 IFNγ由T细胞分泌,通过JAK/STAT1通路诱导转录因子IRF1的表达,IRF1进而与PD-L1的启动子结合,可以上百倍的激活肿瘤细胞PD-L1的转录表达。因此在临床肿瘤组织样本中,经常会看到成簇肿瘤细胞高表达PD-L1,这些肿瘤细胞周围通常有T细胞浸润。Hippo信号通路在调控器官大小、组织稳态、肿瘤发生等过程中发挥着重要作用。最近大量的研究发现,Hippo信号通路在抗肿瘤免疫、抗病毒天然免疫及免疫细胞的调控中也发挥着重要作用。而VGLL4作为Hippo信号通路的转录抑制因子,在抗肿瘤免疫过程中发挥的功能及其作用机制尚不清楚。
在该研究中,宋海课题组利用syngeneic小鼠肿瘤模型发现,Vgll4缺失的小鼠肿瘤细胞在免疫功能健全的小鼠体内生长受到抑制,并在肿瘤组织中观察到大量的炎症细胞浸润,但是在免疫功能缺陷的裸鼠体内生长不受影响。在人肺癌肿瘤细胞中敲低或者敲除VGLL4降低了PD-L1的表达并抑制T细胞杀伤作用。进一步的研究发现,VGLL4对PD-L1的调控是通过调节IRF2BP2的蛋白稳定性实现的。IRF2BP2是IRF2的结合蛋白,IRF2与IRF1具有相同的DNA结合位点,但是不激活转录,通常被认为是IRF1的抑制因子。敲除 IRF2BP2 促进了 IRF2 与 PD-L1 启动子的结合,进而抑制 PD-L1 启动子的活性,抑制PD-L1的表达。此外研究还发现YAP通过其靶基因mir130a抑制VGLL4及IRF1的表达,从而抑制IFNg诱导的PD-L1的表达。VGLL4参与了TEADs及IRF2两个复合物的调控,因此VGLL4可能在调控肿瘤细胞的增殖以及与免疫系统互作中都发挥着重要作用。该研究首次揭示了VGLL4是PD-L1的一个重要调控因子,阐明了VGLL4与YAP共同调控抗肿瘤免疫的作用机制。
宋海课题组博士后吴爱玲为论文的第一作者,宋海教授为本文的通讯作者。该研究得到了国家自然科学基金、浙江省自然科学基金及浙江大学的资助。
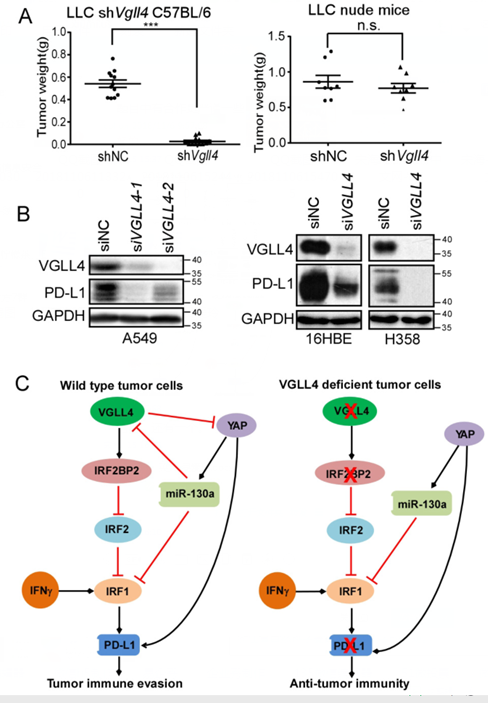
图注:A: 降低小鼠肺癌细胞LLC的VGLL4表达抑制其在C57BL/6体内生长,但是在裸鼠体内生长正常。B: 在肺癌细胞系中敲减VGLL4的表达,抑制肿瘤细胞PD-L1的表达。C: VGLL4及YAP调控PD-L1表达的机制。
原文链接:http://m.emboj.embopress.org/content/early/2018/11/05/embj.201899506




