2019年11月26日,浙江大学生命科学研究院汪方炜实验室在国际著名学术期刊The EMBO Journal在线发表了题为“Histone H2A phosphorylation recruits topoisomerase IIα to centromeres to safeguard genomic stability”的研究论文,揭示了有丝分裂期组蛋白的磷酸化修饰通过招募DNA拓扑异构酶TOP2A保护基因组稳定性的分子机制和功能。
细胞来自于细胞,产生更多细胞的唯一途径是已存在细胞的分裂。所有生物,包括从单细胞的细菌到多细胞的哺乳动物,都是上溯至30亿年前生命起源后连续不断的细胞生长与分裂的结果。以人体为例,从一个受精卵发育成人,大约需要经历30万亿次细胞分裂(Sender R et al., PLoS Biol, 2016)。据粗略估计,一个成年个体每天大约发生500亿次有丝分裂。细胞在有丝分裂期的核心任务是准确地分配它在之前的S期复制的染色体,确保每个子细胞得到一份完整的基因组拷贝。这个过程必须高度精确,否则会造成染色体和基因组的稳定性,进而可能导致细胞的癌变。
如图1所示,在S期DNA复制完成后,每条染色体形成两条相同的姐妹染色单体,它们靠黏连蛋白复合体(Cohesin)和DNA连环(DNA catenation)顺着染色体长轴紧密结合在一起。有丝分裂期染色体的分离需要去除姐妹染色单体间的粘连(cohesion)和DNA连环(catenation),这一过程分两步完成。首先,在有丝分裂的前期和前中期,伴随着Wapl从染色体臂上移除Cohesin的过程,DNA拓扑异构酶IIα(TOP2A)得以去除双链DNA之间的连环和缠绕,从而解除姐妹染色体臂部的物理联结(Hongtao Yu, Curr Biol, 2013)。在此期间,着丝粒区的Cohesin在Sgo1、Sororin和Haspin等蛋白的保护下逃脱Wapl对其的移除 (Morales C & Losada A, Curr Opin Cell Biol, 2018),并拮抗TOP2A对DNA连环的去除作用(Wang L et al., J Cell Sci, 2010; Farcas A et al., Mol Cell, 2011)。随后,在有丝分裂中期向后期转换的过程中,随着蛋白水解酶Separase对Cohesin的剪切,TOP2A须快速高效地去除着丝粒区染色体间的DNA连环,以使得姐妹染色单体及时分离并在纺锤体的牵引下向细胞的两极移动。
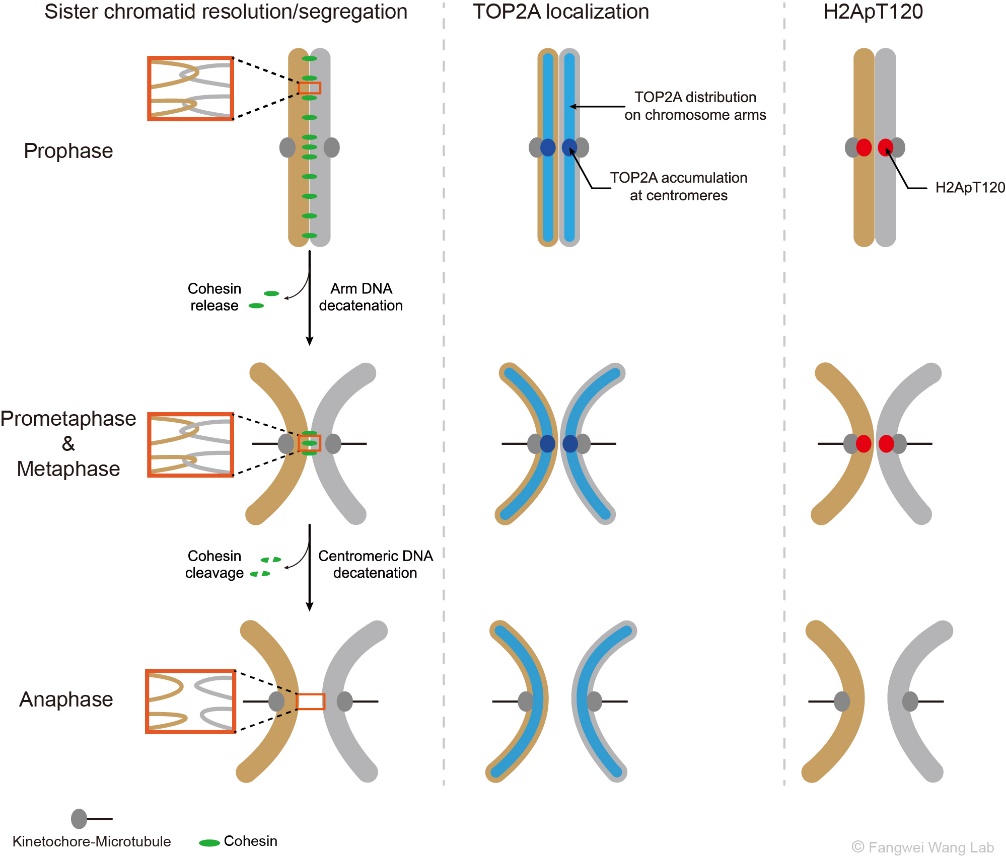
图1:有丝分裂期姐妹染色体的分离(左),以及TOP2A(中)和H2ApT120(右)在染色体上的动态分布和定位。
因此,为了确保有丝分裂期染色体的精确分离,TOP2A必须在染色体分离前就聚集于着丝粒区。事实上,早在二三十年前科学家们就已经发现,TOP2A分布于有丝分裂期染色体的臂部并高度富集于着丝粒区(Earnshaw W et al., J Cell Biol, 1985; Taagepera S et al., Proc Natl Acad Sci USA, 1993; Rattner J et al., J Cell Biol, 1996)。后续的研究进一步发现,类泛素化修饰促进TOP2A在着丝粒区的定位及姐妹染色体的精确分离(Dawlaty M et al., Cell, 2008)。那么,TOP2A在着丝粒区定位的受体分子是什么呢?这个问题的答案一直不为人们所知。
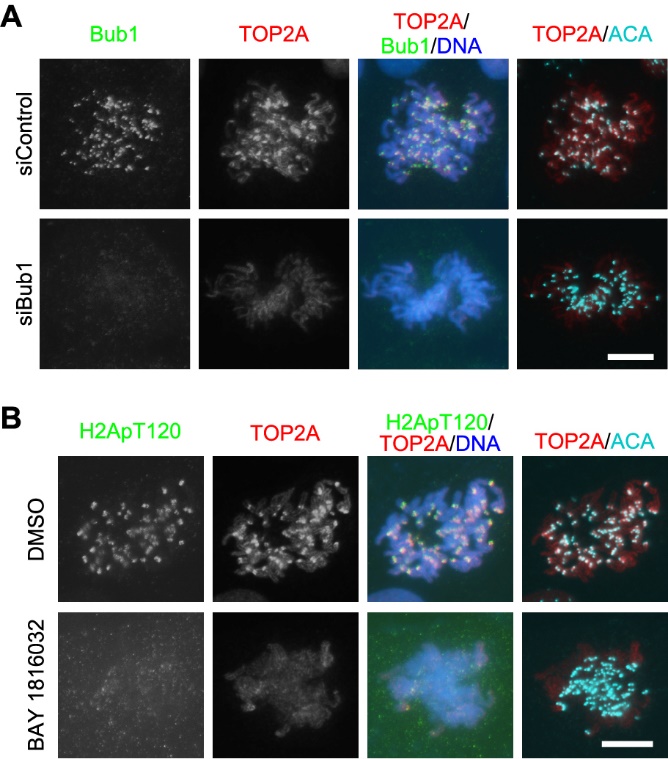
为了解决这一重要科学问题,浙江大学生命科学研究院汪方炜实验室的博士生张妙同学开展了基于RNA干扰技术的筛选工作,并发现了纺锤体检查点蛋白Bub1对于TOP2A在着丝粒区定位的重要性(图2A)。进而,利用小分子化合物抑制Bub1的激酶活性后,TOP2A在着丝粒的定位几乎消失(图2B),说明Bub1的激酶活性对于TOP2A的着丝粒定位是必需的。
图2:敲减Bub1的表达(A)或利用小分子化合物抑制Bub1的激酶活性(B)去除TOP2A在有丝分裂前中期染色体着丝粒区的富集。
已知的Bub1激酶底物有三个,它们分别是纺锤体检查点蛋白Cdc20(Tang Z et al., Mol Cell, 2004; Jia L et al., Nat Commun, 2016)、组蛋白H2A(Kawashima S et al., Science, 2010)以及端粒蛋白TRF1(Li F et al., Mol Cell, 2018)。那么,Bub1是通过磷酸化哪个已知或未知的蛋白底物发挥作用的呢?张妙同学发现,敲减Cdc20或TRF1的表达并不影响TOP2A的着丝粒定位,而TOP2A和Bub1介导的组蛋白H2A第120位苏氨酸的磷酸化(简称H2ApT120)在有丝分裂前期、前中期及中期细胞的着丝粒区有较好的共定位,提示了H2ApT120参与调控TOP2A定位的可能性。接着,张妙同学进行了一系列精巧的实验操作,将H2ApT120人为地产生于细胞周期不同时期的染色体的不同区域,发现它都能招募TOP2A至染色体的相应区域,说明H2ApT120对TOP2A在着丝粒定位是必要且充分的。继而,通过在细胞内表达多种不同的TOP2A突变体,张妙同学发现,位于TOP2A的C-gate区的coiled-coil结构域和羧基端的ChT结构域对于TOP2A定位于着丝粒区是重要的(图3)。
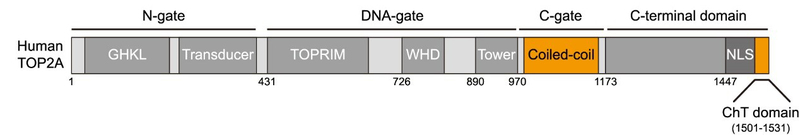
图3:人源TOP2A蛋白的结构域示意图。
那么,H2ApT120对TOP2A的招募作用是直接还是间接的呢?为了解答这个疑问,张妙同学利用林世贤实验室提供的独特技术,从一株改造过的大肠杆菌中表达纯化了第120位苏氨酸被替换为磷酸化的丝氨酸的组蛋白H2A,并在梁材同学的帮助下证实,与野生型的H2A蛋白相比,磷酸化的H2A蛋白与TOP2A蛋白在体外的结合能力明显增强。
这些实验结果不仅展示了H2ApT120对TOP2A的直接招募作用,而且也为探究TOP2A在着丝粒区的功能提供了重要的实验手段。通过破坏H2ApT120与TOP2A的结合,选择性地去除TOP2A在着丝粒区的定位而不影响其在染色体臂上的分布,张妙同学发现,着丝粒区姐妹染色体DNA的去连环(decatenation)作用明显受阻,主要表现为有丝分裂后期细胞中由超细DNA构成的染色体桥(Ultra-fine anaphase DNA bridges)的显著增加(注:此类染色体桥容易发生DNA损伤)。因此,H2ApT120与TOP2A的结合对于解除有丝分裂期姐妹染色单体间的DNA连环是重要的。
这一系列研究结果表明,当细胞进入有丝分裂时,Bub1对组蛋白H2A的磷酸化修饰招募TOP2A至着丝粒,促进着丝粒区DNA连环的去除,进而保证了染色体的精确分离和基因组的稳定性(图4)。基于TOP2抑制剂在癌症化疗中的广泛应用(John Nitiss, Nat Rev Cancer, 2009),以及近期报道的Bub1小分子抑制剂对于癌细胞增殖的抑制作用(Siemeister G et al., Clin Cancer Res, 2019),这项研究也为靶向TOP2A和Bub1的癌症治疗提供了新的视角。
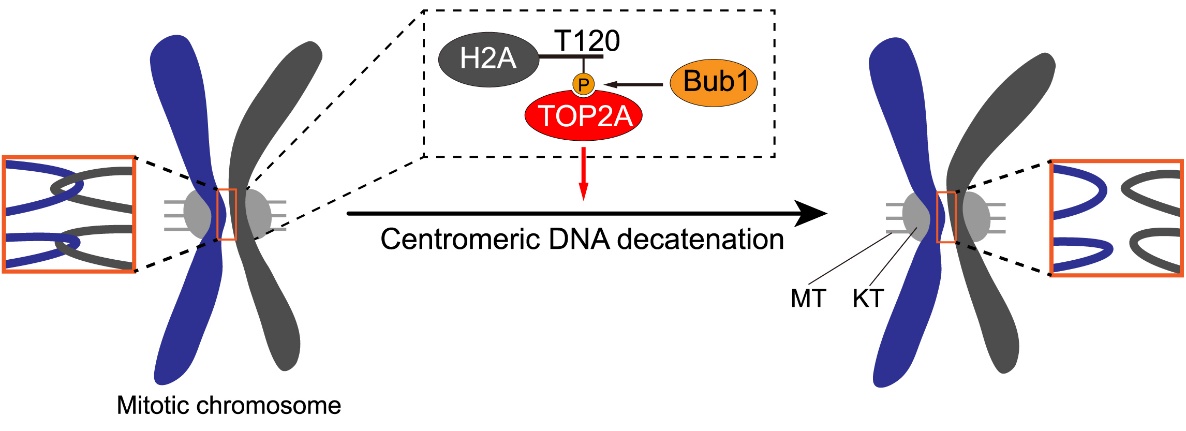
图4:TOP2A在有丝分裂期着丝粒区定位的分子机制及功能。
汪方炜教授是论文的通讯作者,博士生张妙为第一作者,汪方炜实验室的博士生梁材和陈亲富以及林世贤实验室的赵红霞同学等也有贡献。此项研究课题受国家重点研发计划、国家自然科学基金、英国皇家学会牛顿高级学者基金、浙江省自然科学基金、浙江大学校长专项科研基金等的资助。
原文链接:https://www.embopress.org/doi/10.15252/embj.2019101863