自去年11月份被发现以来,SARS-CoV-2 超级毒株奥密克戎(Omicron)迅速在全球传播并逐步取代了先前的受关注突变体(Variants of Concern, VOCs),该毒株在Spike蛋白中有30多个突变,使其能够逃避多数治疗性中和抗体以及一些疫苗的免疫疫。因此,开发针对Omicron的强效中和抗体,具有重要临床意义。
2022年3月28日,生研院朱永群实验室,联合中山大学邓凯实验室、香港大学陈志伟实验室和陆军军医大学叶丽林实验室在Cell Host & Microbe在线发表了题为“35B5 antibody potently neutralizes SARS-CoV-2 Omicron by disrupting the N-glycan switch via a conserved Spike epitope”的论文,报道了新冠VOCs的全谱人源单克隆抗体35B5能够强效中和Omicron,并揭示了其新颖的作用机制。

研究者发现,靶向受体结合结构域(RBD)的单抗35B5不仅能够强效中和先前的VOCs,对Omicron仍具有纳摩尔水平的中和作用。为了研究Omicron免疫逃逸以及35B5强效中和Omicron的结构基础,研究者解析了Omicron Spike胞外区(S-ECD)与35B5 Fab复合物的冷冻电镜结构,发现Omicron S三聚体具有更紧密的结构堆积和更加稳定的构象。进一步分析Omicron的RBD结构域,发现其所包含的15处突变明显改变了RBD的结构和表面静电分布,形成RBD的抗原转移;此外,Omicron的NTD共包含8处突变,其中G142D和L212I位于表面,产生NTD的抗原转移。
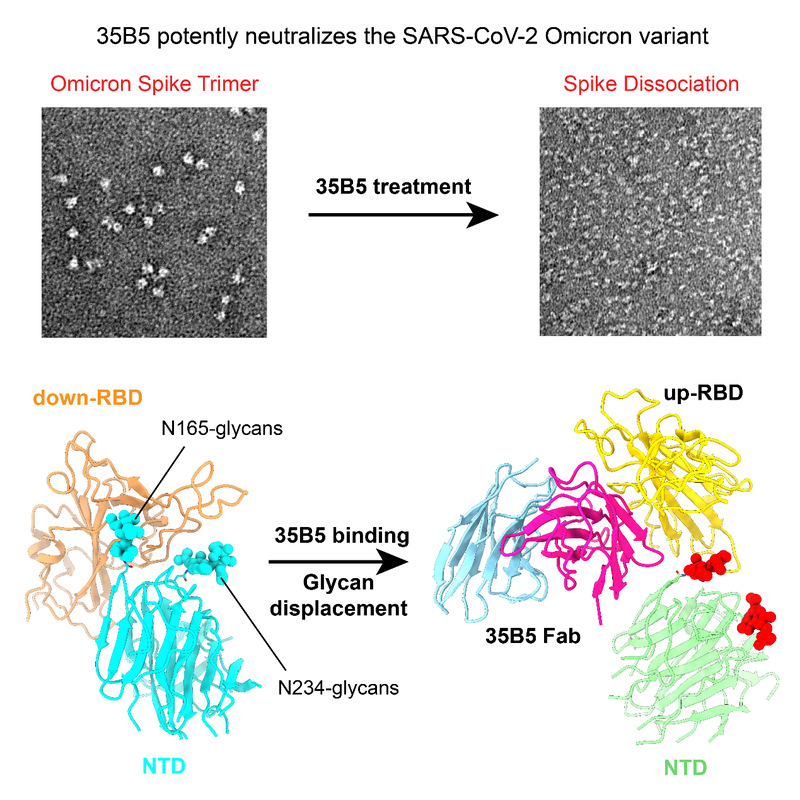
那么,这些变化为什么并不影响35B5对Omicron的靶向作用呢?研究者发现35B5在Omicron RBD上的抗原表位(epitope)在不同VOCs中是不变的,高度保守的epitope是35B5靶向Omicron及其他VOCs RBD的分子基础。接下来,研究者分析了35B5的epitope为什么如此保守?结果发现,35B5表位残基不仅对于RBD的结构完整性和ACE2的结合至关重要,还参与控制了RBD构象的动态转变。RBD被ACE2识别必需RBD由down构象转变为up构象以暴露ACE2表位,NTD上的N165-聚糖和N234-聚糖夹住RBD的两边,如同一个开关控制着RBD的构象转变。其中,N165-聚糖对于维持RBD的down构象发挥关键作用,该聚糖与35B5 epitope上Y351,T470,F490和L452所形成的结合口袋具有大量相互作用。35B5结合S后,N-165聚糖脱离了结合口袋,N234-聚糖也完全释放至溶剂中,从而打开聚糖开关,使得down RBD转变为不稳定的up RBD,并最终导致S三聚体的解离,该独特的聚糖移位机制代表了一种新型的新冠病毒中和机制(如上图所示)。
该项工作表明35B5对新冠VOCs的全谱强效中和作用以及较高的抗原转移耐受性使其成为临床治疗的良好候选药物。在这项工作里,朱永群实验室青年研究员王小飞、博士研究生谭加兴和徐艳完成了电镜相关实验和结构解析;叶丽林实验室的博士生陈香宇等提供了35B5抗体并完成假病毒中和实验;陈志伟实验室的研究员周润宏博士完成了Omicron真病毒中和实验;浙大微生物所的周艳实验室和中山大学的邓凯实验室提供了相关实验试剂。
原文链接:https://doi.org/10.1016/j.chom.2022.03.035




