截至目前,有超过170多种RNA上的化学修饰被报道,这些RNA上的修饰统称为“表观转录组”(epi-transcriptome),它参与调控pre-mRNA剪接、转运出核、稳定性维持与降解以及翻译等mRNA生命周期几乎所有的环节[1,2]。然而,过去几年内RNA修饰领域的研究主要集中的丰度较高的m6A修饰上,关于其他RNA修饰的生理功能与调控机制还知之甚少。RNA上的N4-乙酰胞嘧啶核苷(N4-acetylcytidine)修饰由目前已知唯一的Writer—N-乙酰基转移酶10(NAT10)催化产生,ac4C修饰在原核生物和真核生物中都高度保守,其最早在酵母的tRNALeu和 tRNASer上被鉴定到,随后也在人和酵母的18S rRNA上被发现[3]。最近,有研究首次发现ac4C存在于哺乳动物的mRNA上,ac4C修饰能够增强mRNA的稳定性并促进翻译效率[4]。然而,ac4C修饰在哺乳动物中的生理功能仍然不清楚。
减数分裂过程是有性生殖的基础,也是确保基因组稳定性和遗传多样性的前提。减数分裂过程通过同源染色体配对、联会、同源重组、染色体分离过程最终产生单倍体的配子[5]。然而减I前期这些事件的精确调控机制还不清楚,RNA修饰如何通过转录和转录后水平来调控这些关键事件的发生还知之甚少。
2022年7月8日,生研院范衡宇教授课题组在Nucleic Acids Research杂志上发表了题为“NAT10-mediated N4-Acetylcytidine Modification is Required for Meiosis Entry and Progression in Male Germ Cells”的研究论文,报道了ac4C整体修饰丰度在不同组织以及精子发生过程中的动态变化、雄性生殖细胞特异性Nat10敲除小鼠的表型、以及NAT10介导的ac4C修饰在小鼠精子发生过程中的生理功能和调节机制。
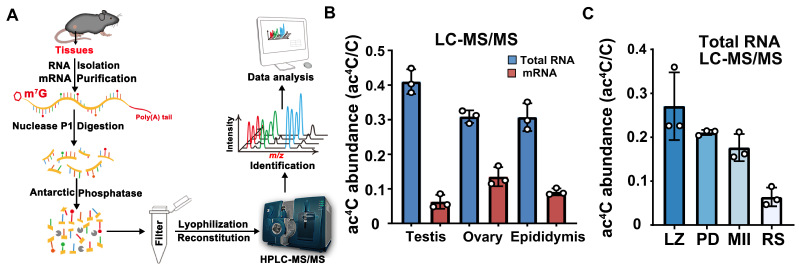
(图1:HPLC-MS/MS检测各组织中及精子发生过程中ac4C修饰水平。A: HPLC-MS/MS检测ac4C修饰水平。B:ac4C修饰在卵巢、睾丸、附睾组织的Total RNA及mRNA上均存在。C:ac4C修饰丰度在小鼠精子发生过程中逐渐降低。)
该研究首先发现NAT10在小鼠的睾丸,卵巢和脾中高表达。进一步发现NAT10在精原细胞和精母细胞中高表达,并且其在第一次减数分裂前期各级精母细胞中存在定位的动态变化。通过Dot-Blot和高效液相色谱串联质谱(HPLC-MS/MS)检测发现整体ac4C修饰水平在睾丸、卵巢、附睾中丰度较高。ac4C在Total RNA和oligo-dT富集的mRNA中均被检测到,mRNA上的修饰丰度远低于Total RNA,这与先前报道相一致。此外,与NAT10的表达趋势相一致,ac4C整体修饰丰度在精子发生过程中逐渐降低(图1)。随后,本研究利用Stra8-GFP Cre构建了在进入减数分裂前生殖细胞特异性敲除Nat10的小鼠模型,该条敲小鼠完全不可生育。表型分析发现Nat10的缺失造成了精原细胞分化,减数分裂进入的异常;其中少数能进入减数分裂的精母细胞存在联会和DSB修复异常,同源重组存在缺陷,最终阻滞在粗线期(Pachytene)阶段(图2)。
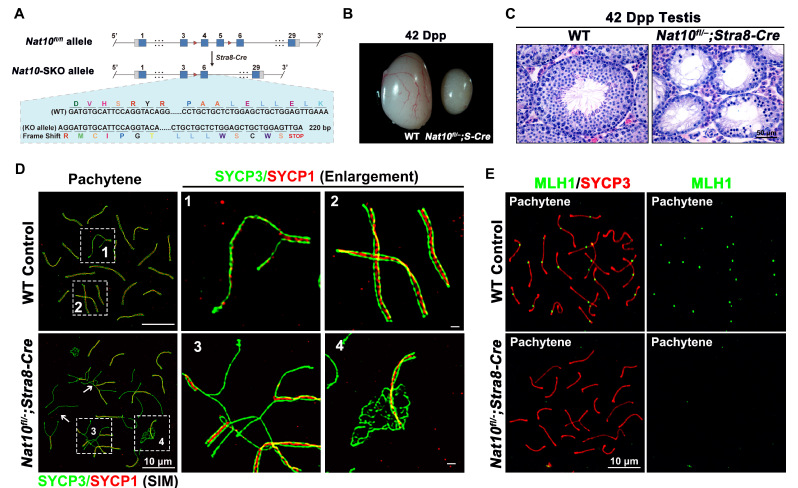
(图2:Nat10缺失导致减数分裂进入,联会过程以及同源重组缺陷。A:利用Stra8-GFP-Cre构建进入减数分裂前生殖细胞条件性敲除小鼠策略。B:Nat10-SKO小鼠睾丸发育异常。C: Nat10缺失造成减数分裂进入缺陷,生殖细胞数目减少。D:超高分辨率显微镜检测发现Nat10缺失导致联会联会复合体组装异常。E: Nat10-SKO小鼠存在减数分裂同源重组缺陷。)
进一步通过流式分选分离出精原细胞(SPG)、前细线期精母细胞(PreL)以及细线期/偶线期精母细胞(LZ)进行转录组测序,分析发现Nat10的缺失造成了大量转录本的表达失调,其中差异表达的基因在细线期/偶线期阶段最为显著,该阶段下调的基因主要参与DSB修复、联会、同源重组等过程,这也与前期表型相一致(图3)。Dot Blot和HPLC-MS/MS结果显示Nat10缺失后睾丸中ac4C整体修饰水平下降,LZ时期下调的转录本中有368个转录本与先前报道富含ac4C修饰的基因存在overlap(图3), 推测ac4C的降低通过影响转录本的稳定性造成参与精子发生的关键基因表达下调,最终造成雄性小鼠不育。
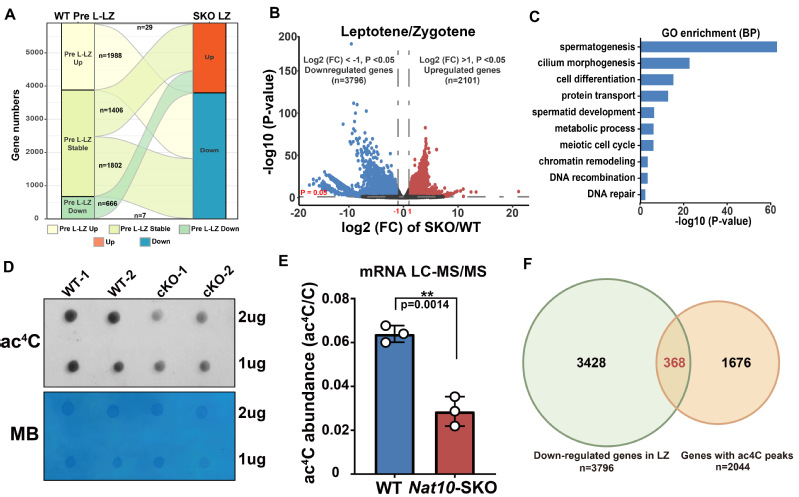
(图3:Nat10缺失导致精子发生关键基因转录本失调以及ac4C水平降低。A: Nat10缺失导致减I前期转录本紊乱。B: Nat10-SKO小鼠细线期/偶线期大量转录本下调。C:LZ时期下调的转录本富集于精子发生、减数分裂、DNA重组及修复过程。D: Dot Blot检测12日龄Nat10-SKO小鼠睾丸组织中ac4C水平。E:HPLC-MS/MS结果显示Nat10缺失后睾丸组织mRNA上ac4C修饰水平显著降低。F:368个携带ac4C peaks 的基因在Nat10-SKO小鼠LZ时期精母细胞中表达下调。)
综上,该研究首次报道了NAT10介导的ac4C修饰在不同组织中丰度存在差异以及在精子发生过程中存在动态变化趋势。也揭示了ac4C修饰writer蛋白NAT10在小鼠精子发生过程中的重要生理功能。然而,现有ac4C测序技术(acRIP-Seq [4]及ac4C-Seq [6])对样本起始量要求较高,难以在敲除小鼠中分选出足够量的精母细胞用于ac4C测序,这也是该领域的技术瓶颈。因此,开发高灵敏度、低起始量、单碱基分辨率的ac4C测序技术对于各个领域深入研究ac4C修饰在生理和病理情况下的动态变化以及调控机制至关重要。
范衡宇组博士研究生陈露、王文静、吴雨珂以及北京大学第三医院助理研究员刘强博士为论文共同第一作者。该工作也得到了上海生化细胞所童明汉研究员、浙大生研院叶存奇研究员、生研院共享技术平台蒋雪樱老师以及医学院流式分选平台黄莹莹老师的帮助。该研究受到国家自然科学基金重大项目、重点项目、科技部重点研发计划以及浙江省自然科学基金重大项目的资助。
原文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkac594/6633898?searchresult=1
参考文献:
[1] Wiener, D. and Schwartz, S. (2021) The epitranscriptome beyond m6A. Nat Rev Genet, 22, 119-131.
[2] Roundtree, I.A., Evans, M.E., Pan, T. and He, C. (2017) Dynamic RNA Modifications in Gene Expression Regulation. Cell, 169, 1187-1200.
[3] Jin, G., Xu, M., Zou, M. and Duan, S. (2020) The Processing, Gene Regulation, Biological Functions, and Clinical Relevance of N4-Acetylcytidine on RNA: A Systematic Review. Mol Ther Nucleic Acids, 20, 13-24.
[4] Arango, D., Sturgill, D., Alhusaini, N., Dillman, A.A., Sweet, T.J., Hanson, G., Hosogane, M., Sinclair, W.R., Nanan, K.K., Mandler, M.D. et al. (2018) Acetylation of Cytidine in mRNA Promotes Translation Efficiency. Cell, 175, 1872-1886 e1824.
[5] Dumont, B.L. (2020) Evolution: Is Recombination Rate Variation Adaptive? Curr Biol, 30, R351-R353.
[6] Sas-Chen, A., Thomas, J.M., Matzov, D., Taoka, M., Nance, K.D., Nir, R., Bryson, K.M., Shachar, R., Liman, G.L.S., Burkhart, B.W. et al. (2020) Dynamic RNA acetylation revealed by quantitative cross-evolutionary mapping. Nature, 583, 638-643.




