2022年11 月15日,生研院赵斌实验室在《Molecular Cell》上在线发表题为“Energy sensor AMPK gamma regulates translation via phosphatase PPP6C independent of AMPK alpha”的研究论文。这一研究通过比较AMPKγ和AMPKα敲除细胞、采用串联亲和纯化、以及磷酸化蛋白质组学分析等方法,揭示了能量感受器AMPKγ可独立于经典的效应亚基AMPKα,调控磷酸酶PPP6C,进而影响其下游底物,例如eEF2的磷酸化,因此介导了细胞能量水平对蛋白质合成的调控。
维持能量水平来驱动运动和物质交换是生命的基本原则之一。AMP-activated protein kinase (AMPK) 能够感受细胞内ATP/AMP/ADP水平,在低能量供给条件下,AMPK磷酸化下游底物,减少ATP的消耗,促进ATP的合成,是细胞内维持能量平衡至关重要的开关。经典的AMPK为异源三聚体,由催化亚基AMPKα、支架蛋白AMPKβ和调节亚基AMPKγ组成。AMPKγ的Bateman结构域能够结合ATP/AMP/ADP,并根据其比例不同导致复合物构象改变,调节AMPKα活性。
该研究通过分析葡萄糖饥饿处理后AMPKγ和AMPKα敲除细胞经典下游底物磷酸化水平发现,以前被认为间接受AMPKα激酶调控的eEF2磷酸化在AMPKγ敲除后下降,但在AMPKα敲除后反而上升。进一步研究表明,AMPKγ可以调控eEF2的去磷酸化。通过磷酸酶文库筛选,鉴定出七个在过表达条件下可以去磷酸化eEF2的磷酸酶,但是在内源水平只有PPP6C的敲减明显导致eEF2磷酸化上升,并且被葡萄糖饥饿所调控。同时,通过对AMPKγ的串联亲和纯化分析发现,AMPKγ能够与PPP6C结合,并且这一结合受到能量水平调控。体内外结果显示,能量缺乏促进AMPKγ和PPP6C的结合,进而抑制PPP6C与eEF2的结合。SILAC定量法对野生型和PPP6C敲低细胞在能量应激状态下磷酸化蛋白质组学定量分析显示,除eEF2外,还有其它磷酸化位点受到类似调控。进一步验证表明,葡萄糖饥饿还能通过AMPKγ-PPP6C调控HSPB1(S82)和PCM1(S93)的磷酸化。
综上所述,该研究首次提出能量感受器AMPKγ还具有独立于AMPKα以外的其它效应分子,例如磷酸酶PPP6C。能量应激失调是代谢综合征和癌症等疾病的重要原因。因此,AMPKγ-PPP6C调控的蛋白质去磷酸化可能在这些疾病中也发挥重要作用。浙江大学生命科学研究院赵斌课题组周琦、中科院上海药物研究所谭敏佳课题组郝兵兵为本文的共同第一作者。通讯作者为赵斌教授、谭敏佳研究员和冯新华教授。该工作还得到了陈帅、叶存奇等合作实验室的大力支持。该研究由国家重点研发计划、国家自然科学基金重点项目、浙江省自然科学基金重点项目等资助。
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S1097276522010589
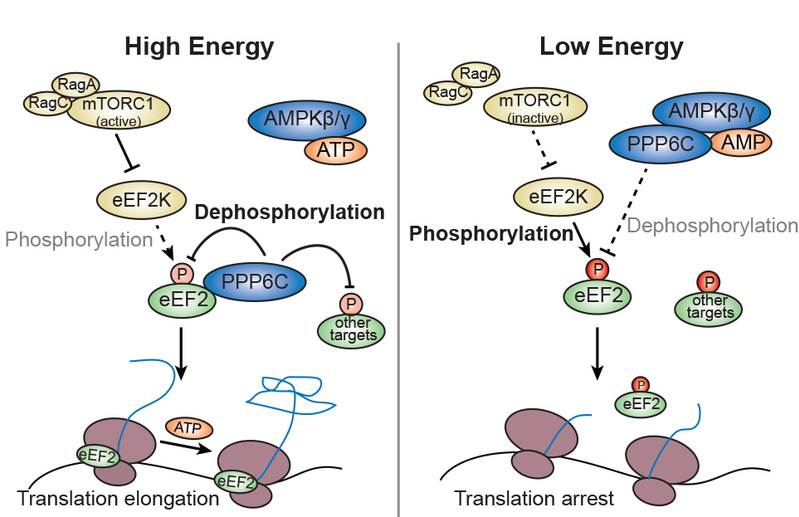
细胞能量水平通过AMPKγ-PPP6C调控蛋白质合成模式图




