尽管蛋氨酸是人体必需的氨基酸,但人体对蛋氨酸的需求随着年龄增长呈下降趋势【1】。过多摄入含蛋氨酸的饮食会影响健康状态,而蛋氨酸限制性饮食往往可以促进机体代谢,改善心血管疾病,提升肿瘤治疗效果等【2,3】。在酵母、线虫、果蝇、小鼠等多种模式生物中,研究人员还发现蛋氨酸限制饮食可以延年益寿【4-6】。在细胞水平上,蛋氨酸可以影响基因转录、蛋白质翻译,组蛋白甲基化修饰、磷酸酶调控、自噬发生等生命活动过程【7-10】,但感应蛋氨酸缺乏并调整代谢的细胞学策略和分子机制仍不清楚。
2023年5月2日,浙江大学生命科学研究院叶存奇团队在Nature Communications上发表了题为Methionine restriction constrains lipoylation and activates mitochondria for nitrogenic synthesis of amino acids的研究论文。该研究报道了线粒体感应蛋氨酸匮乏并平衡能量代谢和氨基酸合成的全新生物学机制。研究人员将这一机制命名为mitoSIR (mitochondria SAM-induced response),并提出这是一个古老且保守的代谢调控机制,其主要目的是在线粒体这个能量代谢与合成代谢的场所,根据蛋氨酸这一含硫氨基酸的丰度,直接控制代谢原料的使用方式。研究人员认为mitoSIR协调能量代谢与合成代谢的能力很可能是蛋氨酸限制饮食发挥功效的关键效应机制。

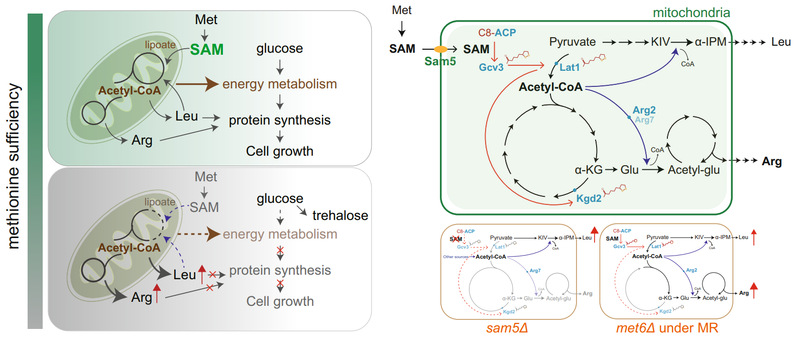
研究人员利用酵母作为研究模型,进行了一系列巧妙的遗传设计,意外地发现细胞在缺乏腺苷甲硫氨酸(SAM)而不是其前体蛋氨酸时,会快速合成其他氨基酸,导致氨基酸大量积累。研究人员利用研究院小分子质谱平台开展了一系列代谢分析、绝对定量以及稳定同位素追踪实验,发现蛋氨酸限制可以促进细胞合成高达毫摩尔浓度级别的精氨酸,并证明了精氨酸合成有利于自噬发生,并数以千倍地提高了细胞对蛋氨酸限制条件的适应能力。研究人员进一步通过遗传学手段对SAM时空合成进行了调整,随之发现如果对线粒体SAM的时序补给出现问题,将激活精氨酸合成,从而说明线粒体对细胞内SAM丰度敏感。通过开展13C葡萄糖代谢流实验,研究人员定位到了受蛋氨酸限制影响的两个关键节点,即丙酮酸脱氢和α-酮戊二酸脱氢反应,提示在蛋氨酸限制时,葡萄糖并未被完全氧化即离开了三羧酸循环。研究进一步证明了在蛋氨酸限制时,乙酰辅酶A通过激活谷氨酸决定了α-酮戊二酸-谷氨酸-精氨酸的代谢发生。
一个关键科学问题是线粒体是如何感受到蛋氨酸限制带来的SAM匮乏条件呢?在蛋氨酸限制条件下,受限的丙酮酸脱氢和α-酮戊二酸脱氢化学反应对应着化学原理类似且结构都很庞大的两个代谢酶复合物,在其中一个亚基上可以发生一个酶活性必需且高度保守的硫辛酰化修饰(lipoylation),而硫辛酸(lipoic acid)的合成依赖于SAM自由基和铁硫簇。通过生化和代谢追踪实验,研究人员成功证明了蛋氨酸减少直接限制了硫辛酸合成。更有意思的是,因为硫辛酸合成后转移到丙酮酸脱氢酶和α-酮戊二酸脱氢酶上的次序不一样,所以这两个被硫辛酰化修饰的酶所受影响的程度也不一样,最后导致了蛋氨酸限制下特异的代谢流向,即乙酰辅酶A与α-酮戊二酸退出TCA循环转至氨基酸合成。研究还发现,当线粒体在极度缺乏SAM的时候,会进一步激活亮氨酸合成,导致乙酰辅酶A上游的丙酮酸也退出能量代谢。
真核细胞具备很多协调营养代谢的方式,比如位于溶酶体上的mTOR信号通路。在高等真核生物中所报道的SAM、精氨酸、亮氨酸丰度信号的感受器在酵母细胞中均不保守。如果从演化适应性的角度看,一个可能的解释是,对于酵母细胞而言,位于线粒体上协调能量代谢与合成代谢的mitoSIR机制可能更有优势。从营养条件上比较,不同于进食周期下的稳定营养补充,单细胞酵母经常会暴露在比较极端的营养条件下。所以,mitoSIR会不会是一个在极端条件下可以被激活的、古老且保守的机制呢?
浙江大学生命科学研究院叶存奇研究员为本文通讯作者。浙江大学博士生方雯、本科生江浏、博士生朱羿冰为本文共同第一作者。该研究由江浏和叶存奇发起,江浏毕业后加入北京大学攻读博士,后由方雯和朱羿冰共同完成,该项目还要感谢博士生杨森、邱宏、程纪瓯、技术员梁庆喜、涂宗财教授对本文作出重要贡献。
叶存奇课题组长期从事细胞代谢和代谢调控的生物学研究,致力于探索未知的代谢现象和原理,重点关注膜磷脂合成、甲硫氨酸代谢,以及相关代谢异常在肾脏等疾病中的病理机制。
原文链接:https://www.nature.com/articles/s41467-023-38289-9
参考文献:
1.Brosnan, J. T. & Brosnan, M. E. The sulfur-containing amino acids: An overview. Journal of Nutrition 136, 1636s-1640s (2006).
2,Sanderson, S. M., Gao, X., Dai, Z. & Locasale, J. W. Methionine metabolism in health and cancer: a nexus of diet and precision medicine. Nat Rev Cancer 19, 625-637, doi:10.1038/s41568-019-0187-8 (2019).
3.Gao, X. et al. Dietary methionine influences therapy in mouse cancer models and alters human metabolism. Nature 572, 397-+, doi:10.1038/s41586-019-1437-3 (2019).
4.Parkhitko, A. A., Jouandin, P., Mohr, S. E. & Perrimon, N. Methionine metabolism and methyltransferases in the regulation of aging and lifespan extension across species. Aging Cell 18, e13034, doi:10.1111/acel.13034 (2019).
5.Miller, R. A. et al. Methionine-deficient diet extends mouse lifespan, slows immune and lens aging, alters glucose, T4, IGF-I and insulin levels, and increases hepatocyte MIF levels and stress resistance. Aging Cell 4, 119-125, doi:10.1111/j.1474-9726.2005.00152.x (2005).
6.McCormick, M. A. et al. A Comprehensive Analysis of Replicative Lifespan in 4,698 Single-Gene Deletion Strains Uncovers Conserved Mechanisms of Aging. Cell metabolism 22, 895-906, doi:10.1016/j.cmet.2015.09.008 (2015).
7.Sutter, B. M., Wu, X., Laxman, S. & Tu, B. P. Methionine inhibits autophagy and promotes growth by inducing the SAM-responsive methylation of PP2A. Cell 154, 403-415, doi:10.1016/j.cell.2013.06.041 (2013).
8.Laxman, S. et al. Sulfur amino acids regulate translational capacity and metabolic homeostasis through modulation of tRNA thiolation. Cell 154, 416-429, doi:10.1016/j.cell.2013.06.043 (2013).
9.Ye, C., Sutter, B. M., Wang, Y., Kuang, Z. & Tu, B. P. A Metabolic Function for Phospholipid and Histone Methylation. Molecular cell 66, 180-193 e188, doi:10.1016/j.molcel.2017.02.026 (2017).
10.Ye, C. et al. Demethylation of the Protein Phosphatase PP2A Promotes Demethylation of Histones to Enable Their Function as a Methyl Group Sink. Molecular cell 73, 1115-1126 e1116, doi:10.1016/j.molcel.2019.01.012 (2019).




