干细胞化学生物学做为新兴交叉学科,利用小分子精准调控干细胞命运、状态和功能,在基础研究、抗衰老、抗肿瘤、再生医学等领域具有广泛应用前景,细胞化学重编程是其焦点之一。相较于转录因子,小分子具有简单方便、易于操控、不插入基因组、处理可逆等优点;因此,使用纯粹小分子组合的化学重编程,不仅可将分化细胞重编程为诱导多能干细胞(Induced pluripotent stem cell, iPSC),而且是一种研究细胞命运可塑性的重要体系。然而,之前已报道的化学重编程体系在速率上与传统转录因子重编程仍存在差距;化学重编程在分子轨迹上与转录因子重编程存在较大差异,说明化学重编程机制独特性;目前化学重编程具体分子机制极不清晰,有待深入发掘。
2023年8月7日,浙江大学生命科学研究院祝赛勇实验室在Nature Cell Biology发表题为“A fast chemical reprogramming system promotes cell identity transition through a diapause-like state”的研究论文,报道了细胞快速化学重编程(Fast chemical reprogramming, FCR)。该研究中作者综合运用多种策略,筛选了20000多个条件,自主研发创建了FCR,大幅度加快了细胞命运重塑进程,将原先约40天的过程缩短至7-12天;在此基础上,利用多组学测序及整合分析,系统描绘了FCR过程中转录与表观遗传动态,并揭示FCR后期经历了一个独特的滞育类似状态;有意思的是,作者还发现异染色质组蛋白修饰H3K9me3通过调控多能性相关ERVs从而做为重编程障碍的独特机制。
从解决化学重编程周期长、效率低等关键问题出发,采取一个与以往研究不同的筛选策略,博士生陈希以最终生成iPSC效率为筛选指标,通过在化学重编程三个阶段分别筛选约7000个小分子,发现了一系列有效小分子可以显著促进重编程:第一阶段发现了SR11237、CD3254和CCT129202,第二阶段发现了TSA、TMP269、Citarinostat、 DMH1、AZD9291 mesylate和SGC-CBP30,第三阶段发现了小分子Vc和WS6。进一步测试发现生长因子mLIF、小分子VPA和R406的作用窗口期为2天,提示化学重编程过程可以细分到每2天一个阶段。随后,综合运用小分子文库筛选、浓度测试、处理时长测试、单个小分子移除试验等手段,通过将有促进效果的小分子加入到化学重编程体系中并调整其浓度和处理时间,最终建立了FCR。在FCR过程中,任何阶段任一小分子或生长因子的移除都会导致iPSC诱导效率的下降,说明这些小分子和生长因子对高效重编程的必要性。关键多能性基因Oct4在重编程第7天就已被激活,进一步说明了FCR的快速性。通过严格的细胞、分子和功能实验验证了FCR- iPSC具有完备的多能性。以上实验证明了FCR是一个快速、高效、安全的不依赖外源转录因子进行多能性重编程获得iPSC的新体系。
在此基础上,作者对整个FCR过程8个时间点取样构建了多组学文库,全面地探索了FCR过程中转录组与表观遗传组的动态变化。作者发现FCR与转录因子重编程在重编程路径上有明显差别,并进一步发现胚外内胚层相关的转录因子推动了两个重编程体系的路径差异。转录组分析结果发现,FCR后期显著下调了核糖体、剪切体、DNA复制相关基因,这一现象提示了FCR后期可能经历一种滞育类似状态。在小鼠中,滞育是一种由环境因素诱导的特殊囊胚状态,引起囊胚细胞增殖减缓甚至停滞,以及蛋白合成速率降低,并导致胚胎着床延后,这一特殊机制有助于后代的存活。小鼠胚胎干细胞也可以通过例如抑制mTOR信号通路、Myc基因敲除或饥饿等手段诱导一个滞育类似状态,处在该状态下的小鼠胚胎干细胞呈现出明显减缓的蛋白翻译和细胞增殖速率。此外,一部分癌细胞也被发现通过进入胚胎滞育细胞的类似状态从而获得化疗抵抗能力。然而,滞育类似状态是否也存在于体细胞重编程为iPSC的过程中仍未可知。本研究中,通过与体内滞育囊胚转录组数据比较以及相应实验证明了FCR在后期经历一种重编程中独有的滞育类似状态。为了排除细胞异质性对RNA-seq结果的干扰,作者在FCR的第0、4、8和12天以及iPSC取样进行了scRNA-seq分析,发现FCR依次经历了成纤维细胞、上皮样细胞、中间态细胞、新生iPSC和iPSC阶段,从而实现细胞命运的逐步重塑。通过SCENIC分析和敲低实验,作者发现并证明了Stat3和Sox7是FCR的重要的中间态转录因子。利用拟时序分析,再次证明了滞育相关基因在FCR成功重编程途径后期细胞中的明显下调,并且通过敲低促进细胞进入滞育状态的关键的基因Larp1、Slc17a5、Prkaa1证明抑制滞育类似状态会导致FCR效率降低,说明滞育类似状态是FCR过程中一个重要的中间态,对于细胞内多能性网络的建立起关键作用。
接下来,作者整合多组学数据进行了联合分析,发现在FCR过程中,动态的染色质可及性位点大部分在FCR中呈现高度动态,伴随着相应组蛋白修饰的动态变化。即使细胞经历滞育类似状态,细胞核内仍发生着剧烈的表观遗传重塑。进一步在全基因组水平上,作者发现异染色质的标志性修饰H3K9me3在FCR过程中都富集于基因组上基因稀疏的区域,这些区域包含大量ERVs。而在FCR过程中,ERVs的表达模式也经历了一个逐步的从MEF向iPSC的动态变化,说明了ERVs可能也会参与并影响重编程过程。H3K9me3已经被证明在多能干细胞中可以调控ERVs,因此,作者筛选找到了24个受H3K9me3调控的iPSC相关的ERVs。iPSC相关的ERVs上有经典Oct4-Sox2-Tcf-Nanog这一多能性转录因子的基序,说明这些ERVs可能参与到多能性网络的构建中。通过敲低和小分子抑制实验,作者证明对H3K9me3甲基转移酶的抑制可以促进FCR,而敲低iPSC相关ERVs导致FCR效率降低。这些结果说明H3K9me3通过抑制iPSC相关的ERVs从而作为FCR的障碍。
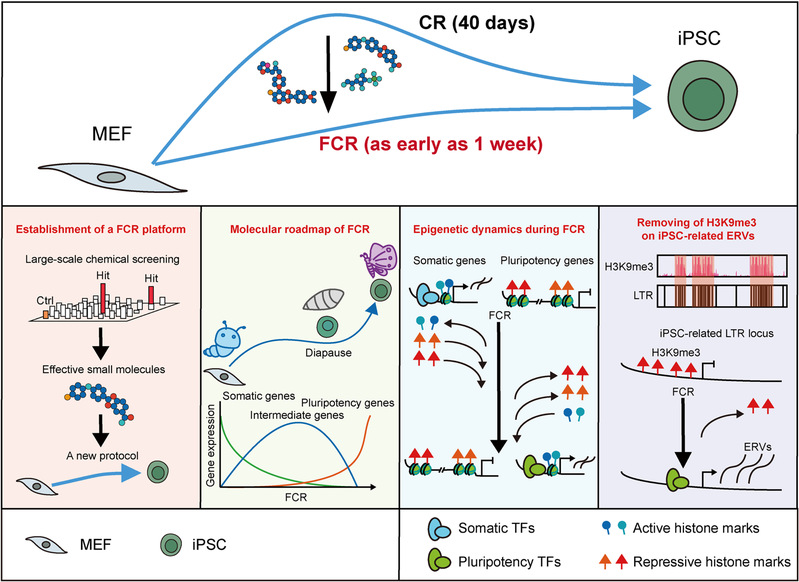
细胞快速化学重编程FCR体系建立及其细胞图谱和分子机制
综上所述,这项研究采用新筛选策略开展大规模小分子筛选,发现了一系列可以促进化学重编程的小分子,并对这些小分子进行最优组合和浓度测试,自主研发了细胞快速化学重编程FCR新体系;利用多组学整合分析,系统描绘了FCR过程基因表达和表观遗传动态,发现其后期经历独特的滞育类似状态,并揭示H3K9me3通过抑制多能性相关ERVs从而阻碍重编程。有意义的是,该研究提供了一个高效快速的细胞化学重编程技术平台,并揭示了独特的细胞命运重塑机制,有助于研究者们进一步探索和理解细胞身份建立与维持的基本原理;该研究为化学重编程技术的临床应用——利用药物提高再生能力缺乏或较弱的组织的可塑性从而应用于再生医学或延缓衰老——提供了理论基础和技术支撑。
该课题受到了国家自然科学基金、科技部重点研发计划、浙江省自然科学基金等项目的资助。该研究得到了李伟教授、傅君芬教授、何向伟教授、赵小阳教授、王昊教授、Professor Holger A. Russ等的大力帮助。浙江大学生命科学研究院祝赛勇实验室长期聚焦在干细胞化学生物学、再生医学等前沿领域,近期研究成果包括细胞快速化学重编程FCR-iPSC、胰岛前体细胞高效扩增及分化ePP-islet等,相关研究成果发表在Nature、Nature Cell Biology、Cell Stem Cell、Nature Communications、Science Advances、EMBO J、PNAS等国际知名期刊。现根据工作需要,公开招聘博士后2-3名,详情请见:http://lsi.zju.edu.cn/25637/list.htm。
原文链接:https://www.nature.com/articles/s41556-023-01193-x




