2024年8月23日,生研院朱永群教授实验室和生科院周艳研究员实验室联合在Cell Research杂志在线发表了题为“Structural basis of the bacterial flagellar motor rotational switching”的研究论文,通过构建激活型趋化因子蛋白CheY突变体,纯化来源于病原菌沙门氏菌(Salmonella Typhimurium)的内源性的、含方向开关复合物胞质环(C ring)的鞭毛马达颗粒,解析了分别处于逆时针和顺时针旋转方向中的、完整的鞭毛马达-接头装置复合物的两个高分辨率冷冻电镜结构,清晰地揭示了CheY蛋白结合导致方向开关复合物的构象变化,提出了鞭毛马达定子单元的内膜重定位概念,从而阐明了细菌鞭毛马达旋转方向转换的分子机制,纠正了之前所有关于C ring的组装和结构的错误理解,向人们展示了完整的细菌鞭毛马达的结构及工作原理。
细菌鞭毛基本结构包括鞭毛丝(filament)、接头装置(hook)以及鞭毛马达(flagellar motor)三部分。鞭毛马达是由镶嵌在细菌细胞膜上的转子(rotor)及其周围锚定的定子单元(stator units)组合而成。定子单元是一种离子通道,可以利用细菌细胞膜内外的离子电化学梯度即离子动力势促使定子单元发生旋转,将化学能转化为机械能来产生扭矩,扭矩经转子结构中位于胞质一侧的胞质环(cytoplasmic ring,C ring)传递到联动杆,再进而传递给接头装置和远端鞭毛丝,从而驱动细菌运动。
细菌鞭毛马达是一个巨大的能双向旋转的分子马达,通赋予了细菌超级运动能力,能驱使细菌每秒钟游动长达自己身长几十倍、甚至上百倍的距离。不仅如此,细菌鞭毛马达能在逆时针和顺时针旋转方向之间进行转换。正常情况下鞭毛逆时针旋转,细菌向前游动。当趋化信号转导通路中CheY蛋白会被磷酸化,磷酸化的CheY(CheY-P)通过结合到C ring,促使鞭毛马达旋转方向从逆时针(CCW)转换为顺时针(CW)方向,最终改变菌体运动方向,因此C ring也被称为方向开关复合物(switch complex)。此外,CheZ可以将CheY-P去磷酸化进而反调控马达的旋转方向。由于C ring结构高度动态且在内源性纯化时容易从鞭毛马达上解聚,因此聚焦于C ring的鞭毛马达旋转方向调控的结构机制研究一直存在不少的障碍,导致细菌鞭毛马达旋转方向转换的分子机制长期不清楚,是领域内长期悬而未决的重要问题之一。

浙江大学朱永群课题组近年来一直研究细菌鞭毛马达工作机制,不断优化沙门氏菌内源性鞭毛马达纯化体系,通过构建激活型CheY突变体(CheY**,即CheYD13K&Y106W突变体),成功获得了逆时针和顺时针旋转状态下沙门氏菌含C ring的完整鞭毛马达-接头装置复合物颗粒,并解析了它们的冷冻电镜结构(图1)。含CCW-C ring的鞭毛马达-接头装置复合物结构共包含341个亚基,由15种不同鞭毛蛋白组成,整体分子量约为10.2MDa,高度约为680Å。而含CheY**结合的CW-C ring的鞭毛马达-接头装置复合物整个模型由375个亚基组成,高度约为664Å。两种旋转状态下的C ring均具有C34对称性,由34个FliG、34个FliM和102个FliN以1:1:3的摩尔比例组成,内部具有广泛且独特的亚基间的交叉互作,可分为内部亚环、上部亚环、中间亚环和底部亚环共计四个亚环。其中,FliG通过堆积致其C端结构域FliGCC排列形成了可以与定子单元互作的上部亚环结构。CheY**的结合导致了C ring的整体结构发生了明显的倾斜和向内收缩,并向MS ring和细菌内膜靠近16 Å的距离(图1)。
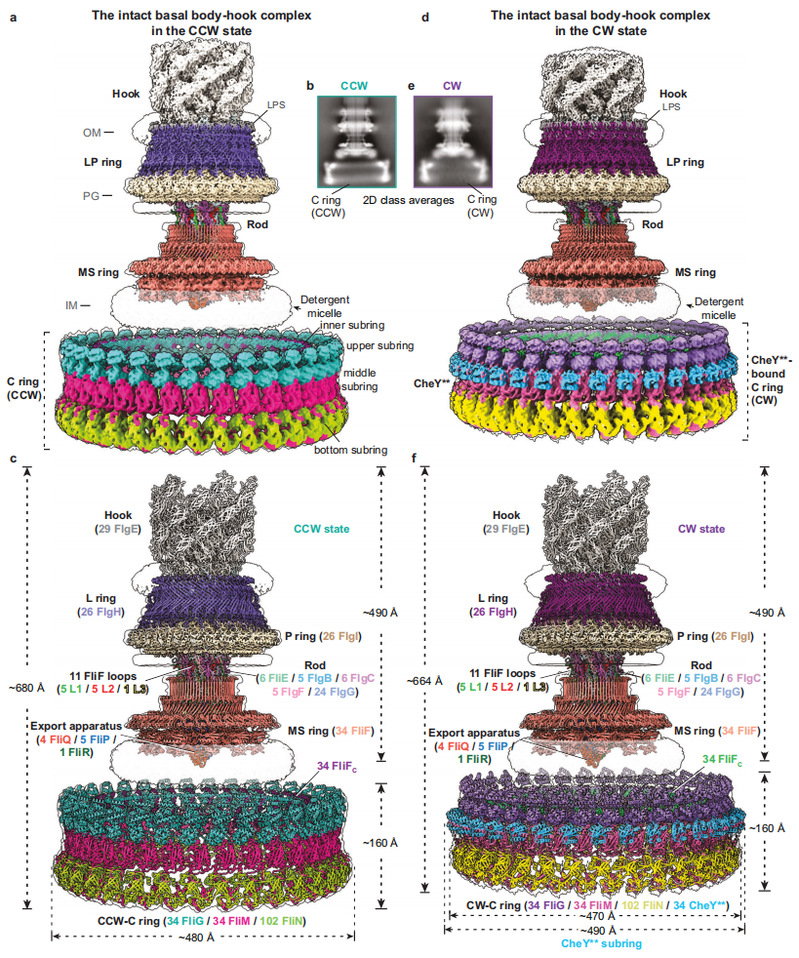
图1. 含方向开关复合物的细菌鞭毛马达在逆时针和顺时针旋转状态下的冷冻电镜电子密度和三维结构。
激活型CheY通过FliM的N端结构域结合在相邻FliMM及FliGM结构域外表面形成的间隙中,导致C ring的各结构单元均出现不同程度的构象变化,特别是FliG亚基的构象发生了巨大变化(图2)。CheY的结合改变了FliG亚基所有结构域的空间位置和结构域间的相对距离,进而导致FliGCC结构域发生了180°旋转并向马达中心移动了10 Å的距离,促使与定子单元互作的FliGCC结构域的核心螺旋结构αtorque出现取向和静电势能分布的翻转。C ring 的构象变化说明定子单元须向马达中心移动,需要在细菌内膜上发生重新定位,以适应αtorque空间位置的变化。通过分析以往报道过的冷冻断层扫描数据,结合建立含定子单元的完整鞭毛马达结构模型(图3),证明了定子单元确实在细菌内膜上发生重新定位。
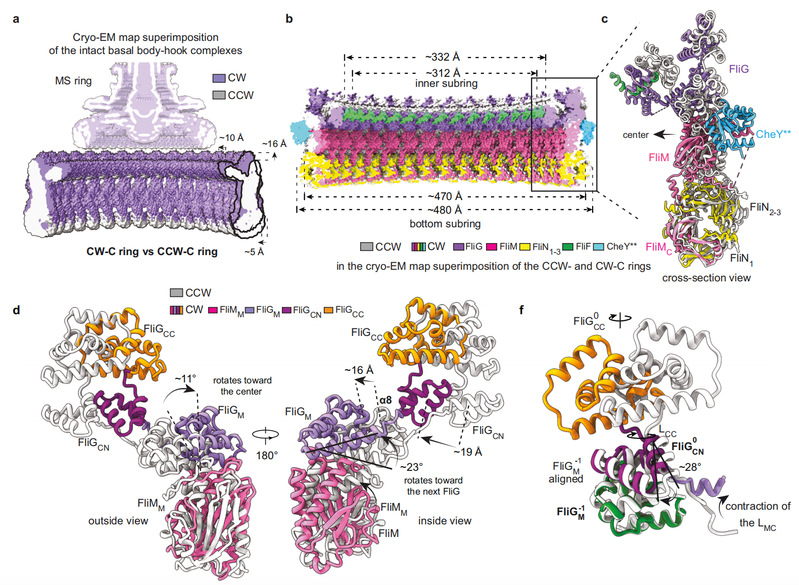
图2. 激活型CheY结合导致C ring发生构象变化。
以上数据分析展示了鞭毛马达方向转换的分子机制:在无CheY蛋白结合时,沿顺时针方向旋转的定子单元位于C ring的FliGCC亚环的外侧,驱动鞭毛马达沿逆时针方向旋转。当CheY结合到C ring时,促进C ring 发生构象变化,向鞭毛马达中心收缩并整体上移,进而引起FliGCC结构域构象变化,最终导致FliGCC上的αtorque发生了180°的翻转,进而实现定子单元从FliG外侧转到内侧,在内膜上发生空间重定位,促使C ring以顺时针方向进行旋转,从而实现鞭毛马达方向的转换(图3)。
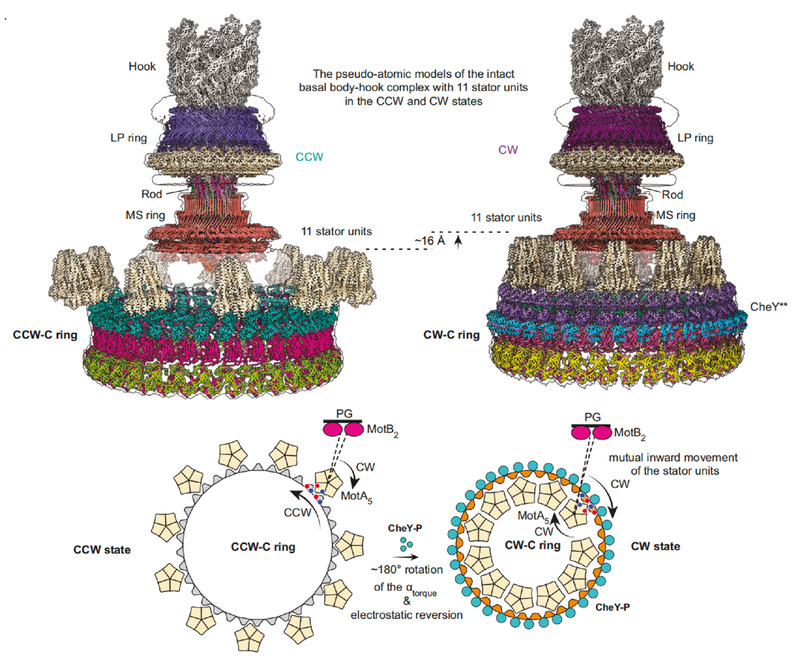
图3. 细菌鞭毛马达方向转换的机制模式图。
这项研究工作纠正了之前所有关于C ring的组装和结构的错误理解,改变了之前认为定子是完全固定在细菌内膜上的概念,反驳了以往所有的关于鞭毛马达方向转换是因为C ring的结构外延这一假说,并向人们展示了完整鞭毛马达三维结构和工作机制,为设计新抗菌药物以及新型旋转纳米机器人奠定了理论基础。
朱永群教授和周艳研究员是本文的通讯作者,谭加兴博士和张玲博士为本文的共同第一作者,参加研究的还有研究生周星彤和韩似玉等。浙江大学、复旦大学、上海交通大学医学院精准医学研究所等单位的冷冻电镜中心参与电镜数据的收集工作。本研究由国家自然科学基金(U23A20163和81925024)、国家重点研发计划(2017YFA0503900)和中央高校基本科研业务费的资助。
原文链接:https://www.nature.com/articles/s41422-024-01017-z




