细胞表型实验
前提:设计实验组和对照组
目的:研究肿瘤细胞表型特征或在特定情况下(相关基因或蛋白改变)肿瘤细胞的表型变化。
内容:细胞凋亡、周期、迁移、侵袭、迁移、趋化、增殖、生长等。
1.细胞凋亡
Ø 概念:是指细胞在一定的生理或病理条件下,受内在遗传机制的控制自动结束生命的过程。
Ø 实验方法:检测试剂盒和细胞流式。
Ø 注意点:进行细胞凋亡实验时,要用不含EDTA的胰酶进行消化。
磷脂酰丝氨酸(PS)正常位于细胞膜内侧,但在细胞凋亡早期,PS可以从细胞膜的内侧翻转到细胞膜的表面,暴露
在细胞外环境。Annexin V是一种钙离子依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin V进行荧光
素FITC标记可以用流式细胞仪进行检测。胰酶中的EDTA能够螯合钙离子,从而削弱Annexin V结合效率,对凋亡实验
造成不可控影响。因此实验时,需要另外购买不含EDTA的胰酶,不能直接使用实验室现有的胰酶。
2.细胞迁移
Ø 目的:测定肿瘤细胞的运动特性方法之一。
Ø 原理:体外培养单层细胞,人为制造空白区域——“划痕”,细胞逐渐进入空白区使划痕愈合。
Ø 实验方法:
1) 培养板接种细胞之前先用marker笔在培养板背面画横线标记(方便定位同一个视野)。
2) Day1, 种板,数量以贴壁后铺满板底为宜(也可在划痕前做其它处理如转染、感染)。
3) Day2,细胞铺满板底后,用10ul枪头比着直尺,垂直于孔板制造细胞划痕,尽量保证各个划痕宽度一致。
4) 用PBS冲洗孔板三次,去除划痕产生的细胞碎片,加入有血清/无血清培养基。
注意点:
² 根据不同细胞系的贴壁情况,选择是否立刻用PBS清洗。例如转染后的huh7细胞系划痕后易飘起。
² 关于有血清/无血清培养基的选择:当划痕实验周期比较短的时候(小于48h),或者不考虑增殖对实验造成的影响,
可以用有血清培养基培养。当划痕实验周期比较长的时候,用无血清或者低血清或者用放线菌酮抑制细胞增殖。
5) 将培养板放入培养箱培养,每隔8-12小时(至少一天2次)取出拍照。
例如RBE细胞隔6小时拍照,拍照间隔和拍照时间要根据不同细胞系决定。
6) 根据收集的图片,分析实验结果,将实验结果量化。
Note:用AI量化结果,建议比较划痕间的距离而非面积。
3.细胞生长和增殖
克隆形成
Ø 克隆的概念:单个细胞在体外增殖6代以上(>1week),其细胞形成的细胞群体。
Ø 目的:克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。(贴壁后的细胞不一定每个都能增殖和形成克隆,
而形成克隆的细胞必为贴壁和有增殖活力的细胞。)
Ø 实验方法:
1) 取对数期生长的细胞,计数种板。
2) 当培养皿中出现肉眼可见的克隆时(3mm),终止培养。弃去上清液,用PBS小心浸洗2次。加甲醇固定15分钟。然后
去固定液,加适量结晶紫染色液染色约15分钟,然后用流水缓慢洗去染色液,空气干燥。
Note:细胞增殖慢且细胞数少时,注意补液,如huh1,培养一周后换液。
3) 拍照定性定量,注意评估染色后的细胞克隆与细胞碎片。
Note:
² 判定是否为克隆,形状规整,大小大于一个定值。
² 克隆形成因为细胞数目少,生长速度慢,缺乏群体效应,不能按照平时传代速度计算细胞形成克隆后的大小。
² 克隆大小有差异,可能是由于细胞本身的干性或者受到外界损伤差异。
MTT
Ø 目的:检测细胞存活和生长。
Ø 原理:活细胞中的酶能够还原外源的MTT,使其沉积在细胞中,通过加入DMSO溶解检测570nm波长(根据购买的MTT选定)的吸光值,间接反映活细胞数量。
Ø 实验方法:
1) 以96孔板为例,液封边缘孔,选择适合的细胞数种板,种5个复孔。
2) 每天同一个时间点,加入MTT(避光,1:10/well添加),4h后加入DMSO,在摇床上使有色物质充分溶解,然后测定
570nm处的吸光值。
4.悬浮小球sphere formation assay
Ø 目的:反映肿瘤细胞的干性特征,能够判断单个细胞在合适的条件培养基中自我更新的能力。
Ø 实验方法:
1) 根据所选的细胞计数,确保形成单细胞悬液,种到低附板中(6孔板,完全培养基)。
2) 培养10-12天后,计数(前5天勿移动、勿更换培养基,可以补液)。
Note:ICC细胞系中RBE和HUCCT1不成球。
5.细胞侵袭
Ø 目的:分析细胞的运动能力。
Ø 原理:Matrigel人造基质膜。滤膜孔径一般为8um,而且膜孔都被Matrigel覆盖,细胞不能自由穿过,必须分泌水解酶,并通过变形运动才能穿过这种铺有Martrigel 的滤膜。肿瘤细胞穿过重建基质膜的能力与它的体内侵袭转移能力表现
出较好的相关性。
在聚碳酸酯膜上涂上一层基质胶,模仿细胞外基质,上层种肿瘤细胞,下层加FBS或实验设定的药物或者影响因子,肿瘤
细
胞在侵袭能力较强的情况下,会分泌相关的酶类消化基质胶,从上室迁移到下室,通过计数进入下室的细胞量测定细胞
的
侵袭能力。
细胞穿膜所用的时间与Martrigel的用量有关。穿过滤膜的细胞多数粘附在滤膜下表面,可用棉签将上表面的细胞拭去,
然后固定染色,在光镜下观察统计穿过Martrigel的细胞数。(侵袭小室不止transwell)
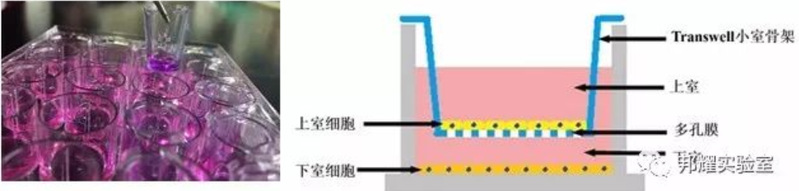
Ø Transwell原理:将小室放入培养板中,小室内称上室(free FBS),培养板内称下室(根据细胞转移力调整FBS浓度),
上下层培养液以膜相隔,并在膜上室铺基质胶,用来模拟体内细胞外基质,如果上室的细胞要转移到下室,需要分泌基
质金属蛋白酶(MMPs)将基质胶降解,才能通过膜,最后通过计数下室的细胞量可反映细胞的侵袭能力,如下图:
Ø 视频:https://www.biomart.cn/experiment/430/488/490/705/206556.html
Ø 应用:
1) 不铺基质胶,Transwell可用于细胞迁移实验。
2) 可用于细胞共培养(研究细胞分泌或代谢物对另一细胞的影响)。
3) 趋化性实验(在下室中加有LN或FN或在滤膜下表面铺上LN或FN,可分析药物对肿瘤细胞的趋化性或趋固性的影响。)
6.细胞共培养
目的:模拟多细胞相互作用。
1) 直接接触共培养:要求生长特征一致的细胞一起培养。
2) 间接接触共培养:
² 爬片式:将细胞先接种到处理的玻片上,贴壁后,放入到另一种细胞的培养皿与其共培养。爬片步骤:
https://wenku.baidu.com/view/916c27baaf1ffc4fff47ac20.html?rec_flag=default&sxts=1580889298279
² 嵌入式:(Transwell共培养)小室铺上PC或PET膜,孔径小于3.0um,一般为0.4um, 细胞不能通过此膜,但是细胞
因子等能够自由通过。l
Note:
² THP1作为悬浮细胞可以直接与贴壁HCC细胞共培养;
² 利用Polyester (PET) Membrane Tissue Culture Plate Insert with 0.4 μm pores (JET biofil)的6孔板,
类似上下两室分别种需要的细胞,数目1:1(约12-15万细胞数目)共培养后,可以提取RNA或蛋白,检测相关基
因;或共培养48-72h,用于表型实验。




