流式分析分选
实验原理
当经荧光染色或标记的单细胞悬液放入样品管中,被高压压入流动室内。流动室内充满鞘液,在鞘液的包裹和推动下,细胞被排成单列,以一定速度从流动室喷口喷出。在流动室的喷口上配有一个超高频的压电晶体,充电后振动,使喷出的液流断裂为均匀的液滴,待测细胞就分散在这些液滴之中。将这些液滴充以正、负不同的电荷,当液滴流经过带有几千伏的偏转板时,在高压电场的作用下偏转,落入各自的收集容器中,没有充电的液滴落入中间的废液容器,从而实现细胞的分离。
流式细胞分选,它可根据发射光的荧光强度和波长将发光颗粒亚群分开并可实现单克隆分选,能复杂样本中的细胞进行鉴定、分类、定量和分离,单次可同时对其中一种到四种特定细胞进行超高速分选纯化、高通量单克隆分选或细胞芯片制备。分选后的细胞能直接用于培养、移植、核酸提取、单细胞PCR扩增或原位杂交等,可进一步进行细胞基因、蛋白、功能水平的研究和不同细胞之间的差异化研究。硬件中样本细胞丢弃的比例低于5%,保证样本中目标细胞的高回收率。
https://baike.baidu.com/item/流式细胞分选
喷嘴的选择
根据细胞的大小与形态,以便选择分选用喷嘴。所分选细胞的直径最好小于喷嘴直径的1/5,至少小于1/3。细胞的形态也会影响了分选的结果,理论上越接近于球形的细胞,分选过程中的剪切力对细胞造成的伤害就越小。形态特殊的细胞应选择较大的喷嘴,以减轻分选过程对细胞造成的伤害。
各种细胞的建议喷嘴如下表(1):
细胞种类和浓度、喷嘴的选择
细胞种类 | 喷嘴 |
Lymphocytes, thymocytes or splenocytes (直径8-12 μm) | 70μm |
Activated lymphocytes, smaller cell lines (直径12-20 μm) | 85 μm |
Large adherent cell line (直径>20 μm) | 100μm |
HUH7建议使用70的喷嘴,目前平台有70,100μm的喷嘴。
抗体的选择
1. 满足所需抗体的基本需求(抗原,识别种属,能用于流式实验)
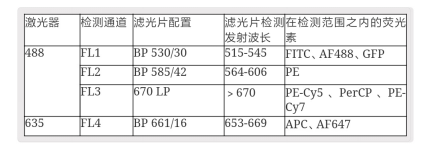
2. 确定流式细胞仪的配置(激光器+探测器)
不同的流式仪器激光器配置不同,所以在使用一个新通道时需要先确定平台的仪器是否可以检测。目前实验室使用的通道有APC,PE,FITC,Percp-cy5.5。
比如BD Calibur是双激光四色,配置的激光器和能够检测的通道如下。
3. 荧光抗体的选择建议
1) 荧光标记:流式抗体荧光标记的方式包括直接标记和间接标记两种。
间接标记二抗会增加实验步骤,多次清洗造成细胞浪费,影响实验的准确性,建议尽量用直接标记的抗体进行实验。
2) 高表达的抗原可用不太“亮”的染料
抗原表达弱或分群不明显建议使用强荧光,反之建议使用弱荧光。
常用荧光强弱排序;PE>APC>PE-cy5>percp-cy5.5>FITC
Stain index(SI)染色指数越高,荧光素越强。
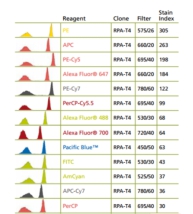
4. 流式多色分析荧光搭配的原则
1) 每个检测通道只能选择一种荧光素。(例如细胞带GFP,就不可以再用FITC通道的抗体去染,会信号重叠)
2) 选择光谱重叠小的染料。最常用的4色荧光搭配是FITC,PE,Percp-cy5.5,APC[2]。
样本制备
1. 样本制备基本流程:
获取细胞悬液→荧光抗体染色→调整细胞浓度(如HUH7,建议300-400w/ml)→过滤细胞→移入流式管→避光置冰上运至分选室→上机检测并设定分选条件→分选细胞→上机回测,检测纯度。
注:分选前的细胞一定要过滤过(一般用300目滤网),否则会堵机器的。
2. 分选所用的细胞染色方法与分析所用方法基本相同,但需要注意以下几点:
a) 保证样本的无菌状态,因为分选得到的细胞还要继续培养;
b) 不能使用固定剂固定细胞,因为活细胞经固定剂处理后即死亡;
c) 保证上机样品为单细胞悬液;
d) 准备充足的细胞;
e) 建议分选上样管中的缓冲液使用含2% FBS的PBS,普通培养基中的酚红可能会干扰分选;若用培养基的话,颜色不能太深,血清浓度不能超过2%,否则粘性太大影响分选。
f) 如细胞分选后需再次培养,请准备含血清的收集管,在分选前交操作员。建议在5ml离心管中加入1-2ml血清及其它必需组分,保证分选完毕时血清浓度大于5%,(建议使用含20%FBS的DMEM);
g) 如要分选GFP等转染的样品,请提供未经转染的相同细胞为阴性对照;
h) 如要做多重荧光染色标本的分选,请提供各种单一荧光染色的标本(如有光谱重叠,需要做荧光补偿调节);
i) 如要去除死细胞,在不影响后续实验前提下,可以加入7-AAD或是PI;
j) 快速简便的样本处理有利于分选:处理好的样本尽快上机,分选好的细胞尽快下一步实验,如果要分选多个样本,建议一次处理一个,估计可能的上机时间后,再处理第二个样本[1]。
3. 抗体染色protocol
1) 消化细胞后离心,用PBS缓冲液(含2%FBS)重悬细胞,制备单细胞悬液,计数。(根据细胞量决定缓冲液的用量)
2) 根据计数结果决定抗体用量,冰浴孵育30min,避光。
3) 离心,800rpm,5min(平离,配平)弃上清。
4) 用500μL PBS缓冲液(含2%FBS)重悬细胞,离心,800rpm, 5min。(平离,配平)弃上清。
5) 用xxulPBS缓冲液(含2%FBS)调整细胞浓度。
6) 准备含20%FBS的DMEM的收集管。同时收两管用15ml离心管,同时收4管用流式管。
另:如果是流式分析,一般初始阶段准备10W细胞,最后用300ulPBS缓冲液(含2%FBS)重悬。
建议日后流式分选使用HBSS+ buffer
其他注意事项及常见问题
Q1. 上机样品需要溶在何种溶液中?是否可以就直接放在原本培养的培养基中?
Ans: 建议不要放培养基中,因为Phenol Red可能会影响分选的结果,可先尝试使用含2%FBS 或BSA的PBS作为分选缓冲液。如要求更好的细胞存活率,按分选细胞的不同,选择不同的分选缓冲液。
1. 淋巴细胞(HBSS配方中的阳离子可增进细胞的生存力。如果这些细胞并非易于群集细胞,可以选用没有EDTA的缓冲液)。
a) 1 mM EDTA, 25mM Hepes (pH7.0) and 0.5% - 2% BSA in 1× PBS (without Ca2+ and Mg2+)
b) 1× HBSS (without phenol red) with 1% BSA
c) 0.5% - 2% BSA in PBS(without Ca2+ and Mg2+)
2. 贴壁细胞(以Trypsin处理后去准备单细胞悬浮液时,待细胞变圆(切记不可过度作用),以适量含5%血清培养液收取细胞,并均匀地打散细胞悬浮液。离心后,用分选缓冲液调整细胞浓度。如果需要的话可以提高EDTA的浓度(至5mM)以避免细胞重新黏聚)。
a) 5 mM EDTA, 25mM Hepes (pH7.0) and 0.5% - 2% BSA in 1× PBS (without Ca2+ and Mg2+)
b) 0.5-2% BSA in PBS(without Ca2+ and Mg2+)
3. 含有高比例死细胞的样本(这些配方可减少因死细胞释放出来的DNA所造成的细胞黏聚现象。)
5mM MgCl2, 1 mM EDTA, 25mM Hepes (pH7.0), 25-50μg/mL DNAase I and 0.5% - 2% BSA in 1× PBS (without Ca2+ and Mg2+)
4. 建议询问有经验者(使用相同细胞进行过分选)的分选缓冲液配方
Q2. 如果细胞要再培养,会污染吗?
Ans: 分选所用的所有溶液都经高温高压灭菌,流式分选仪管路使用70%乙醇定期清洗,仪器所在房间在每次分选前紫外灭菌,最后在细胞培养基中加入抗生素,可将污染机率降至很低。
Q3. 如果我想在分选后拿到1×106的细胞我应该一开始准备多少细胞去做分选?
Ans: 假设你要的细胞只占总数的10%,则你所需准备的细胞数如下公式: 1×106=10%× 50%回收率× 20×106(起始细胞数),所以你需要准备2×107细胞。高速分选、纯度模式(purity vs. yield mode)、部分细胞黏附于上样管壁、部分细胞用于样本分析、长时间分选过程中细胞的死亡等等,对会降低回收率。50%回收率是一个一般的参考值。
Q4. 一个样品可以同时分选出几种细胞?
Ans: FACSAria可以从一个样品中最多同时分选出四种不同的细胞。
Q5. 可以同时使用多少参数进行细胞分选?
Ans: FACSAria最多可以根据15个参数去定义及分选一群细胞 (检测488 nm 激光对应的5种荧光信号及SSC和FSC,监测633 nm 激光对应的2种荧光信号,检测375nm 激光对应的2种荧光信号,另有四个可扩充的空白通道)。
Q6. 分选后细胞的纯度有多少?
Ans: 通常可以达到95%以上的纯度,如果所分选细胞可以和其他细胞群较好的区分。
Q7. 如果阳性的细胞占总数的1%以下,还可以做分选吗?
Ans: 可以,但是低含量细胞的分选会导致低纯度及低回收率。因此,我们建议使用者事先富集你感兴趣的细胞。细胞富集的方式可以是正选:如用磁珠法富集你感兴趣的细胞;也可以是负选,如利用nylon wool去除B细胞,或磁珠法去除不要的细胞。
Q8. 分选时所使用的管子有哪些?
Ans: 上样一般使用5ml带盖流式管(BD Falcon tube #352003);收集可以使用下面这2种管,14ml圆底离心管(BD Falcon tube #352059) (最多双路分选),5ml带盖流式管(Falcon tube #352003) (最多四路分选)[1]。
失败案例分析
1. 分选回来的细胞,做表型实验发现细胞破碎,培养基里漂浮着细胞碎片,基本死亡。

FSC-A代表细胞大小,SSC-A代表胞内复杂程度。FSC-W和SSC-W看细胞粘连程度,像这张图就意味着细胞粘连严重,没有制备成单细胞悬液。即便通过喷嘴,细胞也会被切割力破坏。如果是HCC干性biomarker的检测,建议在细胞密度60-70%的时候收较好。
2. FITC通道分选得到的细胞,阴性里有阳性,阳性里有阴性。
2020.1.20的实验bug,细胞浓度过高,上样过程中多次重新过滤吹打重悬,并且细胞浓度不均一,evt/s波动剧烈(1000-8000),这会严重影响FITC通道的结果,但对APC通道影响较小。
参考文献
[1] 生研院-流式分选细胞注意事项
[2] 如何选择合适的流式抗体https://wk.baidu.com/view/d572185b6c85ec3a87c2c59f




